
科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特殊反应的热效应。?
(1)P4(s,白磷)+5O2(g)![]() P4O10(s) ΔH=-2983.2kJ·mol-1??
P4O10(s) ΔH=-2983.2kJ·mol-1??
(2)P(s,红磷)+5/4O2(g)![]() 1/4P4O10(s) ΔH2=-738.5kJ·mol-1??
1/4P4O10(s) ΔH2=-738.5kJ·mol-1??
则白磷转化为红磷的热化学方程式_________________________。相同的状况下,能量较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。?
科目:高中化学 来源: 题型:
(1)P4(s,白磷)+5O2(g) ![]() P4O10 (s) ΔH=-2 983.2 kJ·mol-1??
P4O10 (s) ΔH=-2 983.2 kJ·mol-1??
(2)P(s,红磷)+![]() O2(g)
O2(g)![]()
![]() P4O10(s) ΔH2=-738.5 kJ·mol-1??
P4O10(s) ΔH2=-738.5 kJ·mol-1??
则白磷转化为红磷的热化学方程式? ?。相同的状况下,能量较低的是 ;白磷的稳定性比红磷? ?(填“高”或“低”)。?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8 kJ·mol-1,下列热化学方程式正确的是 ( )
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+285.8kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=—517.6kJ·mol-1
C.H2(g)+1/2 O2(g)=H2O(g) ΔH=—285.8kJ·mol-1-
D.2H2(g)+O2(g)=2H2O(l) ΔH=+517.6J·mol-1
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
① P4(s,白磷)+ 5O2(g)=P4O10(s); ΔH=—2983.2kJ·mol-1
② P(s,红磷)+ 5/4 O2 (g) =1/4 P4O10(s) ΔH=—738.5kJ·mol-1-
则白磷转化为红磷的热化学方程式_________________________________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省卫辉市高三3月考试化学试卷 题型:填空题
(6分)(1)已知拆开1molH-H键,lmolN-H键,1mol 键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。已知:
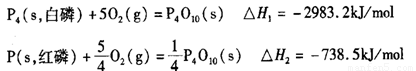
则白磷的稳定性比红磷_____________(填“高”或“低”),理由是________________
__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三上学期第二次月考试卷化学试题 题型:综合题
(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8 kJ·mol-1,下列热化学方程式正确的是 ( )
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+285.8kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=—517.6kJ·mol-1
C.H2(g)+1/2 O2(g)=H2O(g) ΔH=—285.8kJ·mol-1-
D.2H2(g)+O2(g)=2H2O(l) ΔH=+517.6J·mol-1
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
① P4(s,白磷)+ 5O2(g)=P4O10(s); ΔH=—2983.2kJ·mol-1
② P(s,红磷)+ 5/4 O2 (g) =1/4 P4O10(s) ΔH=—738.5kJ·mol-1-
则白磷转化为红磷的热化学方程式_________________________________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com