
【题目】一定温度下,在 3个体积均为 20L的密闭真空容器中发生如下反应(假设容器体积不变,固体试样体积忽略不计):NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
容器 | 温度/℃ | 起始物质的量(n/mol) | 平衡物质的量(n/mol) | ||
n(NH2COONH4) | n(NH3) | n(CO2) | n(CO2) | ||
I | 15 | 1.00 | 0 | 0 | 0.016 |
II | 15 | 2.00 | 0 | 0 | a |
III | 35 | 0 | 4.00 | 2.00 | b |
下列说法不正确的是
A.当反应进行到30min时测得容器Ⅰ中混合气体的物质的量为 0.036mol,则30min 内该反应的平均速率 v(NH3)=4×10-5mol·L-1·min-1
B.当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡
C.若该反应的正反应为吸热反应,则 b一定大于0.032
D.达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ)
【答案】C
【解析】
A. 根据该反应可知,NH2COONH4是固体,此反应生成NH3、CO2的物质的量之比是2:1,NH3占三分之二,而30min时,混合气体的物质的量共为0.036mol,故其中NH3的物质的量为0.024mol,则 30min内该反应的平均速率v(NH3)= =4×10-5mol/(Lmin),A正确;
=4×10-5mol/(Lmin),A正确;
B. 根据该反应可知,NH2COONH4是固体,此反应生成NH3、CO2的物质的量之比是恒定的,即无论平衡与否,二氧化碳的体积分数不变,故当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡,B正确;
C. 容器Ⅱ相当于是将两个容器Ⅰ压缩得到,压缩时化学平衡逆向移动,故a小于0.032mol,若Ⅲ所处的温度和II相同,则Ⅲ和Ⅱ是等效平衡,即若III所处的温度也为15℃,则b=a<0.032mol,但Ⅲ的温度为35℃,升高温度,化学平衡向吸热的正反应方向移动,故平衡时CO2的物质的量增大,但不一定大于0.032mol,C错误;
D. 容器Ⅱ相当于是将两个容器I压缩得到,压缩时气体压强增大,化学平衡逆向移动,故Ⅱ反应达平衡时反应物的转化率低于Ⅰ,即达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ),D正确;
故合理选项是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:
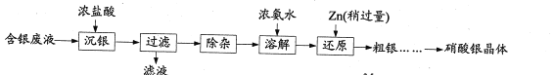
已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
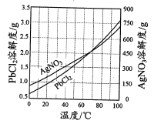
③PbCl2、AgNO3的溶解度曲线如图所示:
(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在海洋碳循环中,通过如图所示的途经固定碳。下列说法错误的是( )
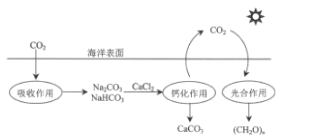
A.该循环过程中未涉及氧化还原反应
B.光合作用能将太阳能转化为化学能
C.钙化作用涉及的离子方程式之一为Ca2++2HCO3-═CaCO3↓+CO2↑+H2O
D.吸收作用中产生HCO3-的途径为CO2+H2OH2CO3,H2CO3HCO3-+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息比 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
W | 基态时, 2p 轨道处于半充满状态 |
X | 自然界中含量最多 |
Y | 是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________(用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________,中心原子的杂化方式为:_______________;
(3)Y的基态原子的价电子排布图为____________________________;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______丙(填“>”或“<”),原因是__________________________________________;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列6种有机物: ①CH3CH2CH2CH3②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() 请回答:
请回答:
(1)属于醇类的是_________(填序号).
(2)与①互为同分异构体的是________(填序号).
(3)与④互为同系物的是_________(填序号).
(4)用系统命名法给③命名,其名称为__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列6种有机物: ①CH3CH2CH2CH3②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() 请回答:
请回答:
(1)属于醇类的是_________(填序号).
(2)与①互为同分异构体的是________(填序号).
(3)与④互为同系物的是_________(填序号).
(4)用系统命名法给③命名,其名称为__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应曾用于检测司机是否酒后驾驶: 2Cr2O+3CH3CH2OH+16H++13H2O![]() 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_______;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为________;1 mol CH3COOH分子含有σ键的数目为________。
(3)与H2O互为等电子体的一种阴离子为________(填化学式);H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲美替尼是一种抑制黑色素瘤的新型抗癌药物,下面是合成曲美替尼中间体G的反应路线:
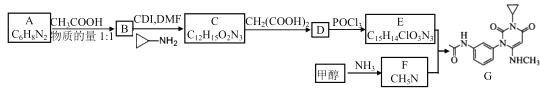
已知:D分子中有2个6元环;
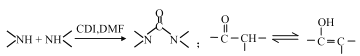
请回答:
(1)化合物A的结构简式___________。
(2)下列说法不正确的是___________。
A. B既能表现碱性又能表现酸性
B. 1mol C在碱溶液中完全水解最多可以消耗 4mol OH-
C. D与POCl3的反应属于取代反应
D. G的分子式为C16H18O3N4
(3)写出C→D的化学方程式_______________________。
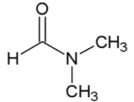
(4)流程中使用的 DMF即N,N-二甲基甲酰胺,是常用的有机溶剂,结构如图。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________。
(5)X是比A多2个碳原子的A的同系物,写出符合下列条件的X可能的结构简式:____________
①1H-NMR谱显示分子中有3种氢原子;②IR谱显示分子中有苯环与-NH2相连结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目的的是

A.向甲烧杯中加入适量CaOB.向甲中试管内滴加适量浓硫酸
C.向乙烧杯中加入适量冰块D.增大甲装置所在环境的压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com