
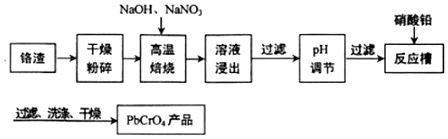
分析 干燥粉碎铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质),加入NaOH、NaNO3,发生反应:5Cr2O3+14NaOH+6NaNO3$\frac{\underline{\;高温\;}}{\;}$10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品,据此分析解答.
解答 解:(1)Cr2O3加入NaOH、NaNO3焙烧得到的产物含有Na2CrO4和氮气,反应为:5Cr2O3+14NaOH+6NaNO3$\frac{\underline{\;高温\;}}{\;}$10Na2CrO4+3N2↑+7H2O;
故答案为:5Cr2O3+14NaOH+6NaNO3$\frac{\underline{\;高温\;}}{\;}$10Na2CrO4+3N2↑+7H2O;
(2)浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,加硝酸可除去NaOH、Na2SiO3、NaAlO2,且不引入新杂质,其中除去铝元素的反应为:AlO2-+H++H2O=Al(OH)3;
故答案为:硝酸;AlO2-+H++H2O=Al(OH)3;
(3)Na2CrO4加入醋酸铅、硝酸铅均可以得到铬酸铅沉淀,为不引入新的杂质,用硝酸铅,得到的NaNO3可以循环利用;
故答案为:①不引入新的杂质②得到的NaNO3可以循环利用;
(4)铬酸铅与硫化氢反应得到硫化铅和铬酸,反应为:PbCrO4+H2S=PbS+H2CrO4;
故答案为:PbCrO4+H2S=PbS+H2CrO4;
(5)加入NH3•H2O,可沉淀Al3+,过滤氢氧化铝沉淀,Cr3+在碱性溶液中的还原性,加入氧化剂过氧化氢可使其转化为CrO42-,从而实现与Al3+的分离;
故答案为:NH3•H2O、H2O2;过滤.
点评 本题考查物质的制备实验及混合物的分离和提纯,为高频考点,把握流程图中每一步发生的反应及操作方法是解本题关键,注意结合题给信息解答,侧重分析与实验能力的考查,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| B. | 为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将(NH4)2Fe(SO4)2•6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴阳离子间通过静电吸引形成的化学键叫做离子键 | |
| B. | HF,HCl,HBr,HI的热稳定性依次增强 | |
| C. | 元素非金属越强,其对应含氧酸的酸性就越强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. (苯环上有两个取代基,其中有一个甲基在对位且属于酯类).
(苯环上有两个取代基,其中有一个甲基在对位且属于酯类).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com