
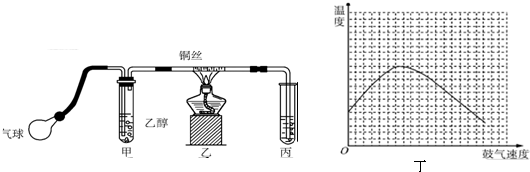
分析 (1)醛类物质含有醛基,能够被银氨溶液、新制的氢氧化铜氧化;
(2)乙醇催化氧化生成乙醛和水;
(3)根据加热时采用水浴加热可以让乙醇平稳气化成乙醇蒸气;根据导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水产生倒吸现象;
(4)根据鼓气的速度和反应体系温度之间的关系来回答;
(5)若是乙醛被氧化,则有乙酸和溴化氢生成,溶液呈强酸性;若是发生加成反应,则生成饱和含溴有机物,溶液仍为中性,故可利用酸碱指示剂来确定哪种猜想是正确的.
解答 解:(1)乙醛中具有醛基,能够被银氨溶液、新制的氢氧化铜氧化,可以使用银氨溶液或新制氢氧化铜溶液来检验,
故选:A C;
(2)乙醇催化氧化生成乙醛和水,化学方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
(3)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气;导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水而使丙装置产生倒吸现象,
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;发生倒吸;
(4)反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,实验中“鼓气速度”这一变量可通过观察甲中冒气泡的速度看出来,
故答案为:过量的气体会将体系中的热量带走;单位时间内甲中的气泡数;
(5)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性;乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应,故操作方法为:用pH试纸检测溴水与褪色后溶液的酸碱性,若酸性明显增强,则猜想①正确,反之猜想②正确,
故答案为:用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确,反之猜想②正确.
点评 本题通过乙醇的催化氧化实验考查了乙醇、乙醛的性质,物质检验方案的设计,明确乙醇的结构及性质是解题关键,侧重考查分析、理解能力及化学实验能力,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
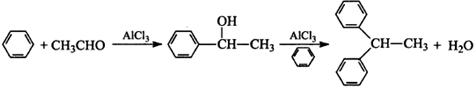
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| C. | 绿色化学反应选择的原料、催化剂、溶剂都应该是无毒无害的 | |
| D. | 乙烯分别与溴水和溴的四氯化碳溶液反应制备1,2-二溴乙烷的原子利用率均为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W单核离子均能破坏水的电离平衡 | |
| B. | W元素氧化物对应水化物的酸性一定强于Z | |
| C. | 含X、Y、Z三种元素组成的化合物不止2种 | |
| D. | 因为X的氢化物分子间有氢键,所以X的氢化物较Z的氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核电荷数为92 | B. | 质子数为143 | C. | 中子数为235 | D. | 核外电子数为235 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物中只存在极性键 | |
| B. | 碳原子最外层有4个电子,在形成化合物时必须与4个原子结合 | |
| C. | 碳原子间可形成非极性键 | |
| D. | 碳原子易失去或获得电子而形成阳离子或阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com