
| A. | 400mL 1mol/L NaCl溶液 | B. | 200mL 2mol/L AlCl3溶液 | ||
| C. | 100mL 1mol/L BaCl2溶液 | D. | 100mL 4mol/L KCl溶液 |
分析 电解质溶液中离子浓度=电解质浓度×化学式中该离子数目,与溶液体积无关,200mL 2mol/L CaCl2溶液中Cl-浓度为4mol/L,结合选项计算判断.
解答 解:200mL 2mol/L CaCl2溶液中Cl-浓度为2×2mol/L=4mol/L.
A.400mL 1mol/L NaCl溶液中Cl-浓度为1×1mol/L=1mol/L,故A不符合;
B.200mL 2mol/L AlCl3溶液中Cl-浓度为3×2mol/L=6mol/L,故B不符合;
C.100mL 1mol/L BaCl2溶液中Cl-浓度为2×1mol/L=2mol/L,故C不符合;
D.100mL 4mol/L KCl溶液中Cl-浓度为1×4mol/L=4mol/L,故D符合,
故选:D.
点评 本题考查物质的量浓度计算,比较基础,注意根据电离方程式理解电解质浓度与电解质离子浓度关系.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
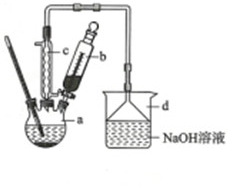
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和 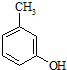 为原料制取.
为原料制取.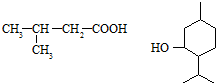 .
.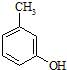 的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含
的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含 ).
). +CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$ 反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成
反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成 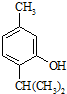 的量远大于生成
的量远大于生成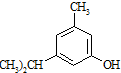 的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.
的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.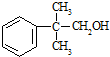 的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 )
的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 ) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
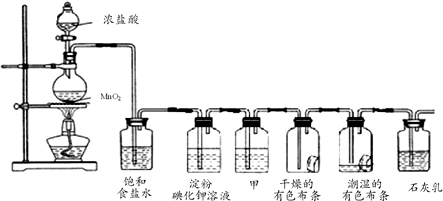
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③④ | C. | ②④⑤ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com