
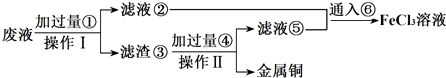
·ÖĪö £Ø1£©ĶÓėĀČ»ÆĢś·“Ӧɜ³ÉĀČ»ÆĶ”¢ĀČ»ÆŃĒĢś£»
£Ø2£©Fe2+¾ßÓŠ»¹ŌŠŌ£¬æÉÓėĖįŠŌøßĆĢĖį¼Ų·¢ÉśŃõ»Æ»¹Ō·“Ó¦£»
£Ø3£©·“Ó¦ÖŠŗ¬ÓŠĀČ»ÆŃĒĢś”¢ĀČ»ÆĶ£¬Óɹ¤ŅÕĮ÷³ĢæÉÖŖ£¬ĀĖŌü¢ŪÖŠŗ¬ÓŠ½šŹōĶ£¬¹ŹÓ¦ŹĒ·ĻŅŗÓė¹żĮæµÄFe·“Ó¦£¬ĀĖŅŗ¢ŚÖŠŗ¬ÓŠĀČ»ÆŃĒĢś£¬ĶØČėĀČĘųæÉŅŌµĆµ½ĀČ»ÆĢś£®ĀĖŌü¢ŪÖŠŗ¬ÓŠ½šŹōĶ”¢Ī“·“Ó¦µÄĢś£¬¼ÓČėŃĪĖį£¬¹żĀĖ£¬»ŲŹÕĶ£¬ĀĖŅŗ¢ŻÖŠŗ¬ÓŠĀČ»ÆŃĒĢś£¬ÓėĀĖŅŗ¢ŚŗĻ²¢£¬ÖʱøĀČ»ÆĢś£»
£Ø4£©FeÓėĀČ»ÆĢś·“Ӧɜ³ÉĀČ»ÆŃĒĢś£¬æÉ·ĄÖ¹ĀČ»ÆŃĒĢś±»Ńõ»Æ£»
£Ø5£©ÓÉÓŚŃõ»ÆŠŌFe3+£¾Cu2+£¬¹ŹĻČ·¢Éś·“Ó¦£ŗ2Fe3++Fe=3Fe2+£¬Č»ŗóŌŁ·¢Éś·“Ó¦£ŗCu2++Fe=Fe2++Cu£¬½įŗĻ·½³ĢŹ½¼ĘĖćŠčŅŖ¼ÓČėFeµÄĪļÖŹµÄĮ棬ŌŁøł¾Żm=nM¼ĘĖć¼ÓČėFeµÄÖŹĮ森
½ā“š ½ā£ŗ£Ø1£©ĶÓėĀČ»ÆĢś·“Ӧɜ³ÉĀČ»ÆĶ”¢ĀČ»ÆŃĒĢś£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCu+2Fe3+=Cu2++2Fe2+£¬¹Ź“š°øĪŖ£ŗCu+2Fe3+=Cu2++2Fe2+£»
£Ø2£©Fe2+¾ßÓŠ»¹ŌŠŌ£¬æÉÓėĖįŠŌøßĆĢĖį¼Ų·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬ČÜŅŗ×ĻÉ«ĶŹČ„£¬¹Ź“š°øĪŖ£ŗĖįŠŌøßĆĢĖį¼Ų£»¼ÓČėĖįŠŌøßĆĢĖį¼ŲČÜŅŗ£¬×ĻÉ«ĶŹČ„£»
£Ø3£©·“Ó¦ÖŠŗ¬ÓŠĀČ»ÆŃĒĢś”¢ĀČ»ÆĶ£¬Óɹ¤ŅÕĮ÷³ĢæÉÖŖ£¬ĀĖŌü¢ŪÖŠŗ¬ÓŠ½šŹōĶ£¬¹ŹÓ¦ŹĒ·ĻŅŗÓė¹żĮæµÄFe·“Ó¦£¬ĀĖŅŗ¢ŚÖŠŗ¬ÓŠĀČ»ÆŃĒĢś£¬ĶØČėĀČĘųæÉŅŌµĆµ½ĀČ»ÆĢś£®ĀĖŌü¢ŪÖŠŗ¬ÓŠ½šŹōĶ”¢Ī“·“Ó¦µÄĢś£¬¼ÓČėŃĪĖį£¬¹żĀĖ£¬»ŲŹÕĶ£¬ĀĖŅŗ¢ŻÖŠŗ¬ÓŠĀČ»ÆŃĒĢś£¬ÓėĀĖŅŗ¢ŚŗĻ²¢£¬ÖʱøĀČ»ÆĢś£¬
²Ł×÷¢ńŗĶ¢ņ¶¼ĪŖ¹żĀĖ£¬ÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠĀ©¶·”¢²£Į§°ō”¢ÉÕ±£¬ĶØČė¢Žŗó·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2Fe2++Cl2=2Fe3++2Cl-£¬
¹Ź“š°øĪŖ£ŗĀ©¶·”¢²£Į§°ō”¢ÉÕ±£»2Fe2++Cl2=2Fe3++2Cl-£»
£Ø4£©±£“ęFeCl2ČÜŅŗŹ±£¬ĪŖĮĖ·ĄÖ¹FeCl2ČÜŅŗ±äÖŹ£¬¾³£ĻņĘäÖŠ¼ÓČėĢś·Ū£¬ĘäŌŅņŹĒ2Fe3++FeØT3Fe2+£¬¹Ź“š°øĪŖ£ŗ2Fe3++FeØT3Fe2+£»
£Ø5£©ČÜŅŗÖŠCuCl2ĪŖ0.2L”Į1.5mol/L=0.3mol£¬FeCl2ĪŖ0.2L”Į3mol/L=0.8mol£¬FeCl3ĪŖ0.2L”Į1.0mol/L=0.2mol£¬
2 Fe3++Fe=3 Fe2+
0.2mol 0.1mol 0.3mol
Cu2++Fe=Fe2++Cu
0.3mol 0.3mol 0.3mol
ŌņŅŖ½«ĶČ«²æ»ŲŹÕ£¬Šč¼ÓČėFe·ŪµÄÖŹĮæÓ¦²»ÉŁÓŚ0.4mol”Į56g/mol=22.4g£®
¹Ź“š°øĪŖ£ŗ22.4g£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»Æѧ¹¤ŅÕĮ÷³Ģ”¢³£ÓĆ»ÆѧÓĆÓļ”¢ŌŖĖŲ»ÆŗĻĪļŠŌÖŹµČÖŖŹ¶£¬ĢāÄæÄŃ¶Č²»“ó£¬ÕĘĪÕŌŖĖŲ»ÆŗĻĪļµÄŠŌÖŹŹĒ¹Ų¼ü£¬ŹŌĢāÅąŃųĮĖѧɜĮé»īÓ¦ÓĆĖłŃ§ÖŖŹ¶µÄÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÄĘŌŚĖ®²ćÖŠ·“Ó¦²¢ĖÄ“¦ÓĪ¶Æ | |
| B£® | ÄĘĶ£ĮōŌŚĆŗÓĶ²ćÖŠ²»·¢Éś·“Ó¦ | |
| C£® | ÄĘŌŚĆŗÓĶµÄŅŗĆęÉĻ·“Ó¦²¢ĖÄ“¦ÓĪ¶Æ | |
| D£® | ÄĘŌŚĖ®ÓėĆŗÓĶµÄ½ēĆꓦ·“Ó¦²¢ÉĻĻĀĢų¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
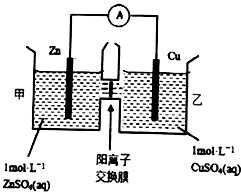
| A£® | Ķµē¼«ÉĻ·¢Éś»¹Ō·“Ó¦ | |
| B£® | µē³Ų¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬼׳ŲµÄc£ØSO42-£©¼õŠ” | |
| C£® | µē³Ų¹¤×÷Ņ»¶ĪŹ±¼äŗó£¬ŅŅ³ŲČÜŅŗµÄ×ÜÖŹĮæ²»±ä | |
| D£® | ŃōĄė×ÓĶعż½»»»Ä¤ĻņÕż¼«ŅĘ¶Æ£¬±£³ÖČÜŅŗÖŠµēŗÉĘ½ŗā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Ģ¼¼°Ęä»ÆŗĻĪļÓŠ¹ć·ŗµÄÓĆĶ¾£®
Ģ¼¼°Ęä»ÆŗĻĪļÓŠ¹ć·ŗµÄÓĆĶ¾£®| ĪĀ¶Č/”ę | ĘšŹ¼ÅضČmol/L | Ę½ŗāÅضČmol/L | |
| CO£Øg£© | H2O£Øg£© | H2£Øg£© | |
| 900 | 2.0 | 0.8 | 0.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 »„ĪŖĶ¬·ÖŅģ¹¹Ģ壬ĒŅÄÜÓėNaOHČÜŅŗ·“Ó¦µÄ»ÆŗĻĪļÓŠ£Ø””””£©
»„ĪŖĶ¬·ÖŅģ¹¹Ģ壬ĒŅÄÜÓėNaOHČÜŅŗ·“Ó¦µÄ»ÆŗĻĪļÓŠ£Ø””””£©| A£® | 9 ÖÖ | B£® | 8 ÖÖ | C£® | 7 ÖÖ | D£® | 10 ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ŹµŃéÄæµÄ | ²£Į§ŅĒĘ÷ |
| A | ·ÖĄėŅŅ“¼ŗĶŅŅĖįµÄ»ģŗĻĪļ | ·ÖŅŗĀ©¶·”¢ÉÕ±”¢²£Į§°ō |
| B | ÓĆ0.10mol/LµÄŃĪĖįÅäÖĘ 100mL 0.050mol/µÄŃĪĖį | 100mLČŻĮæĘ攢ÉÕ±”¢²£Į§°ō”¢½ŗĶ·µĪ¹Ü |
| C | ÓĆäåĖ®”¢µķ·ŪKIČÜŅŗ±Č½Ļ Br2ŗĶI2µÄŃõ»ÆŠŌĒæČõ | ŹŌ¹Ü”¢½ŗĶ·µĪ¹Ü |
| D | ÓĆNH4Cl¹ĢĢåŗĶCa£ØOH£©2¹ĢĢåÖʱø²¢ŹÕ¼ÆNH3 | ¾Ę¾«µĘ”¢ÉÕ±”¢µ¼¹Ü”¢¼ÆĘųĘæ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com