
分析 (1)CuSO4是强酸弱碱盐,铜离子水解导致溶液呈酸性,常温下pH<7,为防止CuSO4水解,所以配制CuSO4溶液时将CuSO4先溶于较浓的硫酸中,然后稀释;
(2)HCO3-和Al3+均可发生水解,且相互促进,产生气体CO2和沉淀Al(OH)3;
(3)明矾水解生成具有吸附性的氢氧化铝胶体;
(4)依据沉淀溶解平衡的溶度积常数表示方法写出,溶度积等于溶液中离子浓度幂次方乘积;
(5)A.依据氯化银沉淀溶解平衡分析,银离子浓度增大,平衡向沉淀方向进行;
B.物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的;
C.氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡;
D.Mg(OH)2的溶解度比MgCO3小;
E.为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全.
解答 解:(1)CuSO4是强酸弱碱盐,铜离子水解方程式为Cu2++2H2O?Cu(OH)2+2H+,水解后溶液中c(H+)>c(OH-),所以溶液呈酸性,即常温下pH<7;为防止CuSO4水解,所以配制CuSO4溶液时将CuSO4先溶于较浓的硫酸中,抑制其水解,然后稀释,
故答案为:酸;抑制;
(2)HCO3-和Al3+均可发生水解,且相互促进,产生气体CO2和沉淀Al(OH)3,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)明矾水解生成氢氧化铝胶体,具有吸附性,反应的离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(4)对于沉淀溶解平衡:Ag2S(s)?2Ag+(aq)+S2-(aq),一定温度下的饱和溶液中存在溶度积常数,Ksp=[Ag+]2•[S2-],故答案为:[Ag+]2•[S2-];
(5)A.氯化银沉淀溶解平衡中存在溶度积常数,Ksp=[Ag+][Cl-],银离子浓度增大,平衡向沉淀方向进行;用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故A正确;
B.物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的;故B错误;
C.氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡;故C正确;
D.Mg(OH)2的溶解度比MgCO3小;故D错误;
E.为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全;故E正确;
故答案为:BD.
点评 本题考查了盐类水解以及难溶电解质的溶解平衡,明确盐类水解原理是解本题关键,注意多元弱酸根离子和多元弱碱离子水解区别,铝离子和碳酸氢根离子易发生双水解而不能共存,常常出现在离子共存的选项中,为易错点.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
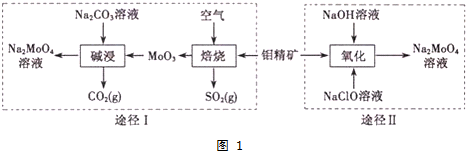

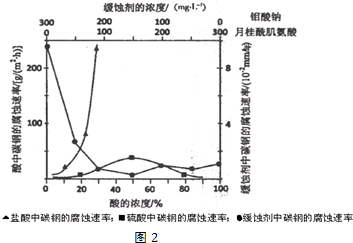
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000ρa}{48a+m}mol/L$ | B. | $\frac{1000ρa}{46a+m}$mol/L | ||
| C. | $\frac{1000ρa}{50a+m}mol/L$ | D. | $\frac{ρa}{46a+m}mol/L$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO分解反应NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)的平衡常数为1×10-30 | |
| B. | 根据K2的值可以判断常温下H2和O2很容易反应生成H2O | |
| C. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2 | |
| D. | 温度升高,上述三个反应的平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 0.5 mol H2SO4与0.5 mol Ba(OH)2完全反应生成BaSO4时放出的热叫做中和热 | |
| C. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐卤或石膏加入豆浆里制成豆腐 | |
| B. | 冶金厂利用高压直流电除去大量粉尘 | |
| C. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O?H3O++S2- | |
| C. | 硫化钾水解:S2-+H2O?HS-+OH- | |
| D. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com