
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是
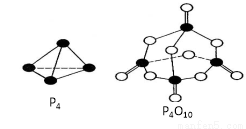
A.(6a+5d-4c-12b)kJ/mol B.(4c+12b-6a-5d)kJ/mol
C.(4c+12b-4a-5d)kJ/mol D.(4a+5d-4c-12b)kJ/mol
科目:高中化学 来源:2014-2015学年山东省济南外国语学校高三上学期期中测试化学试卷(解析版) 题型:填空题
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理基污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)△H=-198kJ•mol-1
2SO3(g)△H=-198kJ•mol-1
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示.
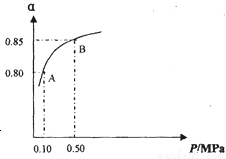
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于 _________________。
②平衡状态由A变到B时.平衡常数K(A)____________K(B)(填“>”、“<”或“=”)
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,放出的热量为:____________kJ
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型图正确的是
A.HClO的结构式:H-Cl-O B.NH3分子的电子式:
C.CO2的比例模型: D.18O的原子结构示意图:
D.18O的原子结构示意图:
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期10月调考理综化学试卷(解析版) 题型:填空题
(15分)燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C

若A为SO2,B为O2,则负极的电极反应式为:________________________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
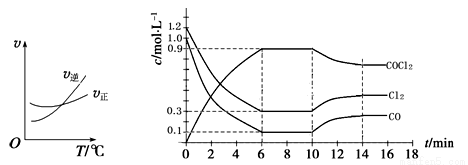
① 0~6 min内,反应的平均速率v(Cl2)= ;
② 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③ 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反 应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④ 随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)______________T(15)(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
化学反应N2+3H2 2NH3的能量变化下图所示,该反应的热化学方程式是
2NH3的能量变化下图所示,该反应的热化学方程式是
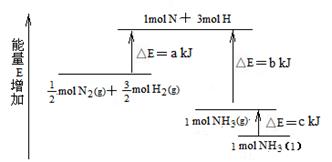
A.N2(g)+3H2(g)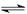 2NH3(1);△H=2(a-b-c)kJ·mol-1
2NH3(1);△H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)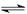 2NH3(g);△H=2(b-a)kJ·mol-1
2NH3(g);△H=2(b-a)kJ·mol-1
C.1/2N2(g)+ 3/2H2(g)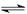 NH3(1);△H=(b+c-a)kJ·mol-1
NH3(1);△H=(b+c-a)kJ·mol-1
D.1/2N2(g)+3/2H2(g)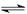 NH3(g);△H=(a+b)kJ·mol-1
NH3(g);△H=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届福建省莆田市高三上学期第一次月考化学试卷(解析版) 题型:选择题
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)·26H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第二次检测化学试卷(解析版) 题型:填空题
【化学与技术】钛铁矿的主要成分可表示为FeTiO3(Ti 为+4 价),某钛铁矿中含FeTiO3 为76%。钛白粉在涂料、塑料、油墨、造纸等行业具有广泛的用途,钛白粉的主要成分为TiO2。利用该钛铁矿生产钛白粉及绿矾的工艺流程如下:

(1)若钛铁矿与浓硫酸反应时Ti 的转化率为92%,操作Ⅰ~Ⅳ中Ti 的转化率均为96%,则1t 该矿石可生产钛白粉(TiO2) t (计算结果保留两位小数,下同),能否计算生成的绿矾(FeSO4·7H2O)的质量? (能则写出计算结果,不能则说明理由)。
(2)钛铁矿与硫酸的反应可表示为FeTiO3+H2SO4 →TiOSO4+X+H2O(未配平)。其中X的化学式为 。
(3)操作Ⅰ的名称是 ,操作Ⅱ包括冷却结晶、 。操作Ⅱ中加入铁粉的目的是 (用离子方程式表示)。
(4)写出操作Ⅲ中TiOSO4水解的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016届上海市高三上学期摸底测试化学试卷(解析版) 题型:填空题
有机推断题(共6分)
有一烃A,能发生如下图所示的一系列转化:

已知两个E分子间可发生缩合反应生成环状化合物C6H8O4,试解答下列问题:
1.写出A和E的结构简式_____________、______________
2.在反应①—⑦属于取代反应的有______________________
写出下列反应的化学方程式:
反应①_________________________
反应④_________________________
反应⑦_________________________
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三10月月考化学试卷(解析版) 题型:选择题
下列实验结论正确的是
A、将某无色气体通入溴水中,溴水颜色褪去,该气体一定是SO2
B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+
C、向某溶液中滴加KSCN溶液不变色,滴加氯水后溶液显红色,原溶液中一定含Fe2+
D、向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com