
化学反应过程中一定伴随着能量变化,某同学通过如下实验进行探究。
Ⅰ.探究化学反应中的能量变化。通过如下实验测出,烧杯中的温度降低。

(1)Ba(OH)2·8H2O跟NH4Cl的反应的化学方程式:
________________________________________________________________。
(2)从反应热的角度分析,该反应属于________(填“吸热”或“放热”)反应;从氧化还原角度分析,该反应属于
________(填“氧化还原”或“非氧化还原”)反应;从基本反应类型上分析,该反应属于________反应。
Ⅱ.测定稀硫酸和氢氧化钠溶液反应的中和热(实验装置如图所示)。

(1)图中尚缺少的一种仪器是________。
(2)实验时环形玻璃搅拌棒的运动方向是________。
a.上下运动 b.左右运动
c.顺时针运动 d.逆时针运动
(3)写出反应的热化学方程式为_______________________________________
________________________________________________________________________(中和热为57.3 kJ·mol-1)。
(4)该同学每次分别取0.50 mol·L-1 50 mL NaOH溶液和0.50 mol·L -130 mL硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
解析 Ⅱ.实验测定中和热ΔH=-53.5 kJ·mol-1与57.3 kJ·mol-1有偏差,是因为实验过程中热量有散失。此实验中硫酸过量,用量筒量取NaOH溶液的体积时仰视读数使NaOH的量偏多,所测中和热数值偏大。
答案 Ⅰ.(1)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3·H2O+8H2O
(2)吸热 非氧化还原 复分解
Ⅱ.(1)温度计 (2)a
(3)NaOH(aq)+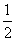 H2SO4(aq)===
H2SO4(aq)===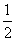 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
或2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
(4)b


科目:高中化学 来源: 题型:
3个氨基酸(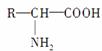 ,烃基R可以相同,也可以不同)分子失去2个水分子缩合成三肽。现有分子式为C36H57O18N11的十一肽完全水解成甘氨酸(C2H5O2N)、丙氨酸(C3H7O2N)、谷氨酸(C5H9O4N),在缩合十一肽化合物时,这3种氨基酸的物质的量之比为( )
,烃基R可以相同,也可以不同)分子失去2个水分子缩合成三肽。现有分子式为C36H57O18N11的十一肽完全水解成甘氨酸(C2H5O2N)、丙氨酸(C3H7O2N)、谷氨酸(C5H9O4N),在缩合十一肽化合物时,这3种氨基酸的物质的量之比为( )
A.3∶3∶5 B.3∶5∶3
C.5∶3∶3 D.8∶7∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
有一反应:2A+B2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是 ( )。
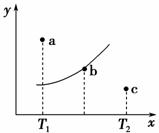
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成
1 mol产物的数据)。

(1)写出表示S8燃烧热的热化学方程式________________________________
________________________________________________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________
_________________________________________________________________。
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)===2NO2(g)
ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1
下列关于肼和NO2反应的热化学方程式中,正确的是 ( )。
A.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l)
ΔH=-1 135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g)
ΔH=-1 000.3 kJ·mol-1
C.N2H4(g)+NO2(g)===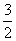 N2(g)+2H2O(l)
N2(g)+2H2O(l)
ΔH=-500.15 kJ·mol-1
D.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g)
ΔH=-1 135.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
选用下列试剂和电极:稀 H2 SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计Ⓖ的指针均明显偏转,则其可能的组合共有 ( )。
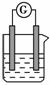
A.6种 B.5种
C.4种 D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论的叙述正确的是 ( )。

| 选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
| A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
| B | Cu | Zn | 稀 H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
| C | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
| D | C | C | FeCl3 | KI、淀粉 混合液 | 若开始时只增大FeCl3溶液浓度,b极附近溶液变蓝的速度加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
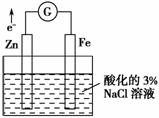
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应________
________________________________________________________________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设。
假设 1 :铁参与反应,被氧化生成Fe2+;
假设 2 :铁参与反应,被氧化生成Fe3+;
假设 3 :________________________________________________________。
(3)为了探究假设1 、2,他采取如下操作:
①取0.01 mol·L-1 FeCl3溶液 2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴 K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴 KSCN 溶液,未见溶液变红。
据②、③、④现象得出的结论是__________________ _____________________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:_________________________________________________________________。
Ⅱ.利用如图所示装置做电解 50 mL 0.5 mol·L-1的 CuCl2 溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2 的氧化性强于IO );
);
B.电解一段时间以后,阴极表面除吸附有铜外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录 A 中试纸颜色的变化,用离子方程式解释:①________________②______________。
(2)分析实验记录 B 中浅蓝色固体可能是_____________________________
(写化学式),试分析生成该物质的原因:________________________________
________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com