
£Ø6·Ö£©ŅŃÖŖ£ŗ¢Ł1mol H2ÖŠµÄ¹²¼Ū¼ü¶ĻĮŃĪüŹÕ436KJÄÜĮ棬0.5mol O2ÖŠµÄ¹²¼Ū¼ü¶ĻĮŃĪüŹÕ249KJÄÜĮ棬ŠĪ³É1molĖ®ÕōĘųÖŠµÄ¹²¼Ū¼üŹĶ·Å930KJ ÄÜĮ攣
¢ŚH2O(l)£½H2O(g) ¦¤H£½+44 kJ”¤mol-1
¢ŪCH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) ”÷H = £890 kJ”¤mol-1
£Ø1£©Š“³öH2 ŌŚO2ÖŠČ¼ÉÕÉś³ÉĖ®ÕōĘųµÄČČ»Æѧ·½³ĢŹ½ £»
£Ø2£©1.12L£ØÕŪĖć³É±źæöĻĀµÄĢå»ż£©H2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®·Å³öµÄČČĮæĪŖ £»
£Ø3£©ŹµŃé²āµĆĒāĘųŗĶ¼×ĶéµÄ»ģŗĻĘųĢå¹²4 molĶźČ«Č¼ÉÕŹ±·ÅČČĪŖ2358kJ£ØÉś³ÉµÄĖ®ĪŖŅŗĢ¬£©£¬Ōņ»ģŗĻĘųĢåÖŠĒāĘųŗĶ¼×ĶéµÄĢå»ż±ČĪŖ ”£
£ØĆ抔Ģā2·Ö£©£Ø1£©H2(g)+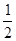 O2(g)==H2O(g) ”÷H= £245kJ/mol
O2(g)==H2O(g) ”÷H= £245kJ/mol
£Ø2£©14.45KJ £Ø3£©1:1
”¾½āĪö”æ漲鷓ӦČČ·ÅČČ¼ĘĖć¼°ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“
£Ø1£©·“Ó¦ČČ¾ĶŹĒ¶Ļ¼üĪüŹÕµÄÄÜĮæŗĶŠĪ³É»Æѧ¼üĖł·Å³öµÄÄÜĮæµÄ²īÖµ£¬Ņņ“Ė·“Ó¦ČČŹĒ436KJ/mol+249KJ/mol£930KJ/mol£½245kJ/mol£¬ĖłŅŌ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒH2(g)+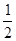 O2(g)==H2O(g) ”÷H= £245kJ/mol”£
O2(g)==H2O(g) ”÷H= £245kJ/mol”£
£Ø2£©±ź×¼×“æöĻĀ1.12LĒāĘųŹĒ0.05mol£¬Č¼ÉÕÉś³ÉĖ®ÕōĘų·ÅČČŹĒ245kJ/mol”Į0.05mol£½12.25kJ”£Éś³ÉĖ®ÕōĘųŹĒ0.05mol£¬±ä³ÉŅŗĢ¬Ė®ÓַųöČČĮæŹĒ44kJ/mol”Į0.05mol£½2.2kJ£¬ĖłŅŌ×īÖշųöµÄČČĮæŹĒ12.25kJ£«2.2kJ£½14.45KJ”£
£Ø3£©Éč»ģŗĻĘųĢåÖŠĒāĘųŗĶ¼×ĶéµÄĪļÖŹµÄĮæ·Ö±šŹĒxŗĶy£¬Ōņx+y£½4mol”£øł¾ŻČČ»Æѧ·½³ĢŹ½æÉÖŖ£¬289kJ/mol”Įx+890 kJ/mol”Įy£½2358kJ£¬½āµĆx£½y£½2mol£¬ĖłŅŌ¶žÕßµÄĢå»żÖ®±ČŹĒ1:1”£


 ³å“Ģ100·Ö1ŗžķĻµĮŠ“š°ø
³å“Ģ100·Ö1ŗžķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 1 |
| 2 |
| 3 |
| 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 2NH3ÖŠ£¬ĆæÉś³É2mol NH3£¬
2NH3ÖŠ£¬ĆæÉś³É2mol NH3£¬²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com