
【题目】综合利用CO2、CO对构建低碳社会有重要意义.
(1)固体氧化物电解池(SOEC)用于高温电解CO2和H2O的混合气体,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图.
①b为电源的(填“正极”或“负极”)
②写出电极c发生的电极反应式、 .
(2)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)CH3OH(g).对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2mol CO和1mol H2 , 达到平衡时容器体积为2L,且含有0.4mol CH3OH(g),则该反应平衡常数值为 , 此时向容器中再通入0.35molCO气体,则此平衡将移动(填“向正反应方向”、“不”或“逆反应方向”).
【答案】
(1)正极;CO2+2e﹣=CO+O2﹣;H2O+2e﹣=H2+O2﹣
(2)50;逆反应方向
【解析】解:(1)①CO2+H2O ![]() CO+H2+O2 , 二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,所以答案是:正极;
CO+H2+O2 , 二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,所以答案是:正极;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e﹣═CO+O2﹣ , 水中的氢元素化合价降低被还原,电极反应式为:H2O+2e﹣=H2+O2﹣ , 所以答案是:CO2+2e﹣═CO+O2﹣;H2O+2e﹣=H2+O2﹣;
(2)
CO(g) | + | 2H2(g) | CH3OH(g) | ||
起始: | 1.2mol | 1mol | 0 | ||
转化 | 0.4mol | 0.8mol | 0.4mol | ||
平衡 | 0.8mol | 0.2mol | 0.4mol |
所以:k= ![]() =50(mol/L)﹣2 ,
=50(mol/L)﹣2 ,
此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L× ![]() =2.5L,则浓度商Qc=
=2.5L,则浓度商Qc=  =54.3,大于平衡常数50,平衡向逆反应方向移动,
=54.3,大于平衡常数50,平衡向逆反应方向移动,
所以答案是:50;逆反应方向.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)已知:FeO(s)+CO(g)FeO(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如右表:
T(K) | 938 | 1100 |
K | 0.68 | 0.40 |
①该反应平衡常数的表达式是 .
②在体积固定的密闭容器中该反应达到平衡状态后,升高温度混合气体的平均相对分子质
量(填“增大”、“减小”或“不变”)曰该反应正反应是反应(填“吸热”或“放热”).
(2)常温下,下列溶液的浓度均为0.1molL﹣1 , 测得溶液pH值如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①由表中数据分析,上述溶质中的阴离子水解程度最小的是(填离子符号).
②由表中数据分析,0.01molL﹣1的下列溶液,酸性最弱的是(填编号).
A、H2CO3 B、HClO C、C6H5OH D、CH3COOH
③向氯水中加入少量的碳酸钠,可以增加氯水中HClO的浓度.为什么? . (请结合化学反应简要说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5molL﹣1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2X(g)+Y(s)2Z(g)的反应过程和能量关系图,下列说法正确的是( ) 
A.曲线a和b表示两个反应过程的反应热不同
B.曲线a一定表示反应是在无催化剂时的反应过程
C.增大压强,X的转化率一定增大
D.反应达平衡,升高温度,平衡常数K值一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙酸是一种弱酸,不能和碳酸钙反应放出二氧化碳气体
B.润滑油属于酯类
C.没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液
D.糖类、油脂、蛋白质都是由C,H,O三种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)已知拆开1molH2、1molO2和液态水中1molO﹣H键使之成为气态原子所需的能量分别为436kJ、496kJ和462kJ;CH3OH(g)的燃烧热为627kJmol﹣1则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=kJmol﹣1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K=;
(3)已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示.该反应的△H0(填“>”或“<”),若温度不变,减小反应投料比[ ![]() ],则K将(填“增大”、“减小”或“不变”).
],则K将(填“增大”、“减小”或“不变”). 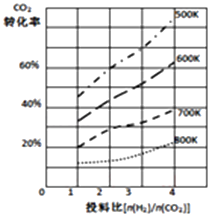
(4)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是;
A.二氧化碳的浓度
B.容器中的压强
C.气体的密度
D.CH3OCH3与H2O的物质的量之比.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com