
| A. | ②④⑤ | B. | ①③⑥ | C. | ②③ | D. | ②⑤ |
分析 ①氯化铁溶液中氯离子结合银离子形成白色沉淀;
②FeCl3溶液和Na2SO4溶液不能发生反应;
③氯化铁溶液水解显酸性,加入氧化铜溶解;
④二氧化硫具有还原性,氯化铁具有氧化性,二者发生氧化还原反应;
⑤稀硝酸和氯化铁溶液不发生反应;
⑥过氧化氢在氯化铁溶液催化作用下分解生成水和氧气;
解答 解:①氯化铁溶液中氯离子结合银离子形成白色沉淀,Ag++Cl-=AgCl↓,发生化学变化,故①不符合;
②FeCl3溶液和Na2SO4溶液不能发生反应,无化学变化,故②符合;
③氯化铁溶液水解显酸性,加入氧化铜溶解,发生化学反应,故③不符合;
④二氧化硫具有还原性,氯化铁具有氧化性,二者发生氧化还原反应,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故④不符合;
⑤稀硝酸和氯化铁溶液不发生反应,无化学变化,故⑤符合;
⑥过氧化氢在氯化铁溶液催化作用下分解生成水和氧气,2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑,故⑥不符合;
故选D.
点评 本题考查了氯化铁溶液性质分析,主要是氯化铁溶液水解性、氧化性的分析,注意过氧化氢分解反应的催化剂作用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 含NA个N2和O2的混合气体中质子数不可能是15NA | |
| B. | 1 L 1 mol•L-1的CH3COONa溶液中CH3COOH和CH3COO-的总数为NA | |
| C. | 58g 分子式为C4H10的有机物中,所含有的甲基数一定为2NA | |
| D. | NA个CH4和NA个Cl2光照下充分反应,被取代的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | 无色溶液中:Fe2+、Na+、ClO-、Cl- | |
| C. | 室温下,$\frac{KW}{c({H}^{+})}$=0.1mol•L-1的溶液中:Na+、K+、SiO32-、NO3- | |
| D. | 滴入KSCN溶液显红色的溶液中:K+、Na+、SO42-、C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
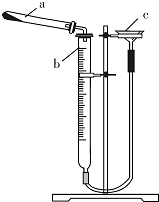 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH-)>c(A-) | |
| B. | 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 | |
| C. | 稀氨水中部分粒子的浓度大小关系:c(NH3•H2O)>c(OH-)>c(NH4+)>c(H+) | |
| D. | 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnCl2是氧化产物,又是还原产物 | |
| B. | ZnI2是氧化产物,又是还原产物 | |
| C. | ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂 | |
| D. | ICl跟H2O的反应,是自身氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
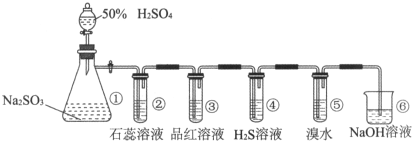
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com