
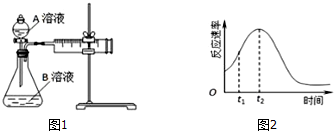
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| △C |
| △t |
| 4.48×10-3L |
| 22.4L/mol |
| n |
| V |
| 0.00026mol |
| 0.05L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸钠溶液显碱性 |
| B、10mLpH=2的醋酸溶液加水稀释到100mLpH<3 |
| C、中和10mL0.1mol?L-1醋酸溶液,需要消耗0.1mol?L-1氢氧化钠溶液10mL |
| D、0.1 mol?L-1的醋酸溶液中,氢离子浓度约为0.001 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的装置在实验室中用途比较广泛:
如图所示的装置在实验室中用途比较广泛:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com