
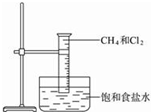
 图是研究甲烷与氯气反应的实验装置图
图是研究甲烷与氯气反应的实验装置图分析 (1)CH4与Cl2反应需光照条件;
(2)二氯甲烷无同分异构体;
(3)CH4与Cl2在光照条件下能生成CH3Cl和HCl,CH3Cl能继续和氯气取代生成二氯甲烷和HCl;
解答 解:(1)CH4与Cl2反应需光照条件下进行,
故答案为:光照;
(2)由于甲烷为正四面体结构,而二氯甲烷是用两个氯原子取代了甲烷中的两个-H原子,故只有一种结构,无同分异构体,
故答案为:1;
(3)CH4与Cl2在光照条件下能生成CH3Cl和HCl,CH3Cl能继续和氯气取代生成 CH2Cl2和HCl,故化学方程式为:CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl,
故答案为:CH2Cl2;取代.
点评 本题考查甲烷与氯气发生取代反应的实验,注意甲烷与氯气发生取代反应原理是高频考点,题目较简单.


科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中生成1 mol Cl2,转移电子2 mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
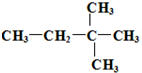 由另一种烃D通过加成反应而制得,则烃D的可能的是
由另一种烃D通过加成反应而制得,则烃D的可能的是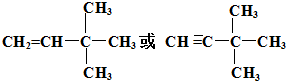 (任写一种可能的结构简式)
(任写一种可能的结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验中,温度计水银球应位于蒸馏烧瓶中液面以下 | |
| B. | 制备乙酸乙酯的实验中,导管末端要伸入饱和Na2CO3溶液液面下 | |
| C. | 分液操作中,待下层液体流出后,将上层液体从分液漏斗上口倒出 | |
| D. | 测定溶液pH时,可用pH试纸蘸取少量待测液并与标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | B和其他3种元素均能形成离子化合物 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
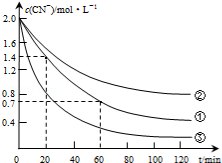 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
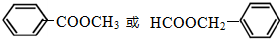 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
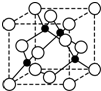 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题:
A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题: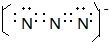 ;
;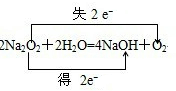 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com