
���ݵ���������Ӧ���Ȼ�ѧ����ʽ
��1��I2(g)+ H2(g) 2HI(g) ��H����9��48 kJ/mol
2HI(g) ��H����9��48 kJ/mol
��2��I2(s)+ H2(g) 2HI(g) ��H����26��48 kJ/mol
2HI(g) ��H����26��48 kJ/mol
�����ж���ȷ����
| A��254 g I2(g)��ͨ��2 gH2(g)����Ӧ����9��48 kJ |
| B��1 mol��̬����1 mol��̬���������������17��00 kJ |
| C����Ӧ��2���ķ�Ӧ���������ȷ�Ӧ��1���ķ�Ӧ���������� |
| D����Ӧ��1���IJ���ȷ�Ӧ��2���IJ����ȶ� |
C
�������������n(I2)= 254 g��254 g/mol=1mol;n(H2)=" 2" g��2 g/mol=1mol, n(I2): n(H2)=1:1,���Ϸ���ʽ�е����ʵ����ıȣ������ڸ÷�ӦΪ���淴Ӧ�����Բ�������ȫ��Ӧ�����Է�Ӧ�ų�������С��9��48 kJ������B������Ŀ�����������Ȼ�ѧ����ʽ��֪��1 mol��̬����1 mol��̬���������������(26��48 +9��48) kJ = 35��96 kJ������C��������Ӧ�����������������ͬ������Ӧ���������ǰ�ߴ��ں��ߣ����Է�Ӧ��2���ķ�Ӧ���������ȷ�Ӧ��1���ķ�Ӧ���������͡���ȷ��D��ͬ����������Խ��Խ�¶ȡ�����Ӧ��1���IJ����뷴Ӧ��2���IJ���״̬��ͬ�������ȶ���Ҳ��ͬ������
���㣺������淴Ӧ���ص㼰���ʵ��ȶ����������Ĺ�ϵ��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ͼʾ���Ӧ�������������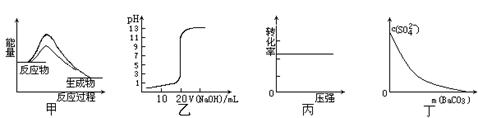
| A��ͼ�ױ�ʾʹ�ô����÷�Ӧ�Ħ�H��С |
| B��ͼ�ұ�ʾ0��10mol��L-1 NaOH��Һ�ζ�20��00mL0��10mol��L-1 CH3COOH��Һ���õ��� �ζ����� |
C��ͼ����ʾ��ӦH2(g) + I2(g)  2HI(g)��H2��ת������ѹǿ�ı仯 2HI(g)��H2��ת������ѹǿ�ı仯 |
| D��ͼ����ʾ�ڱ���Na2SO4��Һ����BaCO3�������Һ��c(SO42-)��Ũ�ȱ仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���������Ȼ�ѧ����ʽ
��1��C(s)+O2(g)=CO2(g) ��H1=-393��5 kJ/mol
��2��H2(g)+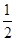 O2(g)=H2O��1�� ��H2=-285��8 kJ/mol
O2(g)=H2O��1�� ��H2=-285��8 kJ/mol
��3��CH3COOH��1��+2O2(g)=2CO2(g)+2H2O��1�� ��H3=-870��3 kJ/mol
���Լ����2C(s)+2H2(g)+O2(g)=CH3COOH��1���ġ�HΪ
| A����H=+244��1kJ/mol | B����H=-488��3 kJ/mol |
| C����H=-996��6 kJ/mol | D����H=+996��6 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ʢ��NH4HCO3��ĩ��С�ձ�����ʢ����������Ĵ��ձ��С�Ȼ����С�ձ��м������ᣬ��Ӧ���ң����������̡��ɴ˿ɼ�
| A�����ֽⷴӦ�������ȷ�Ӧ |
| B��NH4HCO3������ķ�Ӧ�����ȷ�Ӧ |
| C����Ӧ�������������������������� |
| D����Ӧ���Ȼ�ѧ����ʽΪ��NH4HCO3+HCl=NH4Cl+CO2��+H2O��H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
δ������Դ���ص�����Դ�ḻ���Ի�����ȾС���ҿ�����������������δ������Դ����
����Ȼ�� ��ú ������ ��ʯ�� ��̫���� ���������� �߷���
| A���٢ڢۢ� | B���ۢݢޢ� | C���ܢݢޢ� | D���٢ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��25�桢101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22.68 kJ,�����Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A��CH3OH��l��+ O2��g��=CO2��g��+2H2O��l������H="+725.8" kJ/mol O2��g��=CO2��g��+2H2O��l������H="+725.8" kJ/mol |
| B��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l������H=��1452 kJ/mol |
| C��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l������H=��725.8 kJ/mol |
| D��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l������H="+1452" kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ�Ħ�Hǰ��С�ں��ߵ���
��C(s)+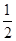 O2(g) ===CO(g)����H1 C(s)+O2(g) ===CO2(g)����H2
O2(g) ===CO(g)����H1 C(s)+O2(g) ===CO2(g)����H2
��S(g)+O2(g) ===SO2(g)����H3 S(s)+O2(g) ===SO2(g)����H4
��CaO(s)+H2O(l) ===Ca(OH)2(s)����H5 CaCO3(s) ===CaO(s)+CO2(g)����H6
| A���� | B���٢� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��˹�����������Ϳ�ѧ�о����к���Ҫ�����塣��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
��Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H����24.8kJ��mol��1
��3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) ��H����47.4kJ��mol��1
��Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ��H����640.5kJ��mol��1
д��CO���廹ԭFeO����õ�Fe �����CO2������Ȼ�ѧ��Ӧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ҵ������������У�SO2�ڽӴ����б�������ΪSO3����֪�÷�ӦΪ���ȷ�Ӧ���ֽ�2 mol SO2��1 mol O2����һ�ܱ�������ַ�Ӧ�ų�����98.3 kJ����ʱ���SO2��ת����Ϊ50%�������Ȼ�ѧ����ʽ��ȷ����(����)��
A��2SO3(g) 2SO2(g)��O2(g) ��H����196.6 kJ��mol��1 2SO2(g)��O2(g) ��H����196.6 kJ��mol��1 |
B��2SO2(g)��O2(g) SO3(g)��H����98.3 kJ��mol��1 SO3(g)��H����98.3 kJ��mol��1 |
C��SO2(g)��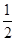 O2(g) O2(g) SO3(g)��H����98.3 kJ��mol��1 SO3(g)��H����98.3 kJ��mol��1 |
D��SO2(g)��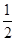 O2(g) O2(g) SO3(g)��H����196.6 kJ��mol��1 SO3(g)��H����196.6 kJ��mol��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com