
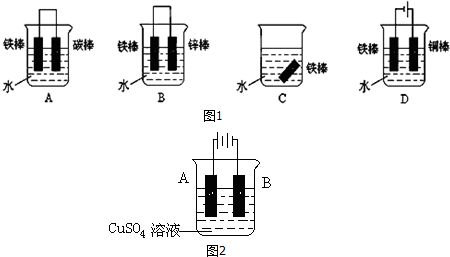
分析 (1)高温条件下,氧化铁和一氧化碳发生氧化还原反应生成铁和二氧化碳;
(2)钢铁在中性环境下发生吸氧腐蚀,正极上氧气放电,负极是铁失去电子生成亚铁离子,生成氢氧化亚铁被氧气氧化生成氢氧化铁,分解得到铁锈;
(3)铁锈的成分是Fe2O3•xH2O,能和盐酸反应生成氯化铁和水,铁和氯化铁发生氧化还原反应生成氯化亚铁;
(4)作原电池正极或作电解池阴极的铁被保护;
(5)①电镀时,镀层作阳极,镀件作阴极;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,根据析出铜质量和转移电子之间的关系式计算;
③作原电池负极的金属易被腐蚀.
解答 解:(1)高温条件下,氧化铁和一氧化碳发生氧化还原反应生成铁和二氧化碳,反应方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 ,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 ;
(2)钢铁在中性环境下发生吸氧腐蚀,正极上氧气放电:O2+4e-+2H2O=4OH-,负极电极反应:Fe-2e-=Fe2+,反应生成Fe2++2OH-=Fe(OH)2,2Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3+(x-3)H2O=Fe2O3•xH2O,铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式为:4Fe+3O2+xH2O=2Fe2O3•xH2O,
故答案为:4Fe+3O2+xH2O=2Fe2O3•xH2O;
(3)铁锈的成分是Fe2O3•xH2O,能和盐酸反应生成氯化铁和水,氯化铁具有氧化性,能和铁发生氧化还原反应生成氯化亚铁,
反应方程式为2FeCl3+Fe═3FeCl2,
故答案为:2FeCl3+Fe═3FeCl2;
(4)作原电池正极或作电解池阴极的铁被保护,
A.该装置能构成原电池,但铁作负极,加速被腐蚀,故A错误;
B.该装置能构成原电池,铁作正极而被保护,故B正确;
C.铁和水接触不能被保护,故C错误;
D.该装置是电解池,铁作阴极而被保护,故D正确;
故选B D,
故答案为:BD;
(5)①在铁上镀铜时,铜作阳极连接原电池正极,铁作阴极连接原电池负极,所以A为铜,B为铁,铁电极上铜离子得电子生成铜单质,
电极反应式为 Cu2++2e-═Cu,
故答案为:铜;Cu2++2e-═Cu;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,
所以阴极上析出铜的质量=5.12g×$\frac{1}{2}$=2.56g,转移电子的物质的量=$\frac{2.56g}{64g/mol}$=0.08 mol,
故答案为:0.08;
③铜、铁和电解质溶液构成的原电池中,铁作负极而加速被腐蚀,铁、锌和电解质溶液构成的原电池中,铁作正极被保护,所以镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀;
点评 本题以铁为载体考查了金属的冶炼、原电池和电解池原理等知识点,根据电镀原理、金属的腐蚀与防护来分析解答即可,易错题是(5)②,很多同学往往认为两极的质量差全部为阴极析出的铜而导致错误,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.4 | B. | 8 | C. | 3.2 | D. | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时将液体沿着玻璃棒注入过滤器,并使液面高于滤纸边缘 | |
| B. | 蒸馏时烧瓶需要垫石棉网 | |
| C. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 | |
| D. | 冷凝管的进水方向是低进高出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蓝色逐渐消失的原因是Na2SO3溶液具有漂白性 | |
| B. | 第一步反应的离子方程式ClO-+2I-+2H+═I2+Cl-+H2O | |
| C. | 淀粉KI溶液变蓝是因为I-被氧化为I2,I2使淀粉变蓝色 | |
| D. | 微粒的氧化性由强到弱的顺序是ClO->I2>SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
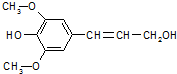 膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A. | 不能与FeCl3溶液发生显色反应 | |
| B. | 分子中所有碳原子不可能在同一平面 | |
| C. | 分子式是C11H14O4,属于芳香族化合物 | |
| D. | 能发生氧化、取代、水解等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Cu2+、NO3- | B. | Na+、NO3-、Fe2+ | C. | Mg2+、NH4+、Cl- | D. | Ba2+、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X分子式是C5H10O2 | |
| B. | X难溶于乙醇 | |
| C. | 分子式为 C4H8O2且官能团与X相同的物质有4种 | |
| D. | X完全燃烧后生成CO2和H2O的物质的量比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com