
| A. | 常温常压下,11.2 L氧气含有的原子数目为NA | |
| B. | 锌从盐酸中置换出1 mol H2,转移的电子数目为NA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 NA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、在锌和盐酸的反应中,氢元素的价态由+1价变为0价;
C、分子个数N=$\frac{m}{M}{N}_{A}$;
D、溶液体积不明确.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氧气的物质的量小于0.5mol,则含有的氧原子个数小于NA个,故A错误;
B、在锌和盐酸的反应中,氢元素的价态由+1价变为0价,故当生成1mol氢气时,转移2NA个电子,故B错误;
C、分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{4.4g}{44g/mol}×{N}_{A}/mol$=0.1NA个,故C正确;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
 有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
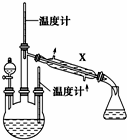 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中含有少量的CH3COOH | |
| B. | 醋酸钠溶液的pH大于7 | |
| C. | 醋酸钠溶液中滴入酚酞显红色,加热后颜色变深 | |
| D. | 醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4g S02与足量氧气反应生成S03,转移电子数小于0.2 NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L 0.5mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 | |
| B. | 铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含Fe2O3 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| D. | 检验Cu2+和Fe3+离子,采用径向纸层析法,待离子在滤纸上展开后,用浓氨水熏,可以检验出Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可向海水中加入明矾使海水淡化从而解决淡水供应危机 | |
| B. | 福尔马林可用于浸制标本,是因为其能使蛋白质变性 | |
| C. | 应用酒精的浓度通常为75% | |
| D. | 向烟花中添加含钠、钙、铜等金属元素的化合物可在燃烧时产生绚丽缤纷的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的摩尔质量为36.5 g/mol,O2的摩尔质量为16g/mol | |
| B. | 常温下,2.7克铝与足量的盐酸反应,失去的电子数为0.3 NA | |
| C. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| D. | 标准状况下,11.2 L CCl4中含氯原子数为2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com