

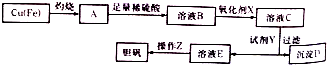
分析 由所给的流程可知:硫酸亚铁铵晶体溶于水后加入草酸生成FeC2O4•2H2O沉淀出来,此沉淀经氧化亚铁离子变为三价铁离子,然后制得所要的产品即可;
(1)亚铁离子变质为铁离子,铁离子利用KSCN溶液验证;亚铁离子在水溶液中水解,加入稀硫酸抑制水解;
(2)据所给反应物和生成物书写即可,依据洗涤沉淀的正确方法解答即可,洗涤需要多次,且水应浸没固体,待水自然流下;
(3)温度较高时,H2O2分解;
(4)依据信息“K3[Fe(C2O4)3]-3H2O(三草酸合铁酸钾晶体)为草绿色晶体.溶于水,难溶于乙醇”回答;
(5)分离乙醇和水的方法是蒸馏;蒸馏常用仪器是蒸馏烧瓶、温度计、冷凝管和牛角管、锥形瓶.
解答 解:(1)硫酸亚铁若变质,则被氧化为铁离子,铁离子与KSCN溶液显示血红色,溶解的过程中要加入几滴稀硫酸,目的是亚铁离子在水溶液中水解,加入稀硫酸抑制水解,故答案为:KSCN;抑制Fe2+水解;
(2)草酸与硫酸亚铁铵反应生成硫酸铵、硫酸和FeC2O4•2H2O沉淀,化学反应方程式为:(NH4)2Fe(SO4)2•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O
,洗涤沉淀的方法为:向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作数次,故答案为:(NH4)2Fe(SO4)2•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O;
(3)温度较高时,H2O2分解,加6%的H2O2时,温度不能过高,温度过低反应速率小,反应后煮沸的目的是除去过量的双氧水,故答案为:温度太高双氧水容易分解,温度太低反应速率太慢;除去过量的双氧水;
(4)K3[Fe(C2O4)3]-3H2O(三草酸合铁酸钾晶体)为草绿色晶体.溶于水,难溶于乙醇,所以最好的洗涤试剂是乙醇,故答案为:C;
(5)乙醇和水互溶,利用蒸馏的方法分离乙醇和水,蒸馏所用的仪器为蒸馏烧瓶、温度计、冷凝管和牛角管和锥形瓶,故答案为:蒸馏; 蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶.
点评 本题主要考查溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 0.20 | 20.80 |
| 第三次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 燃烧一定要有氧气参加 | |
| C. | 吸热反应在常温下也有可能发生 | |
| D. | 氧化还原反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com