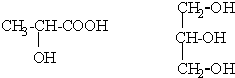甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
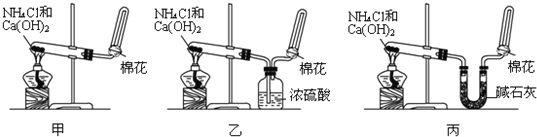
(1)三位同学制取氨气的化学方程式为:
(2)三位同学都用向下排空气法收集氨气,其原因是
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是
填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是
(用化学方程式表示).
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是
(填“甲”、“乙”或“丙”),该装置中的NH
4HCO
3固体能否用NH
4CL固体代替NH
3?
(填“能”或“不能”).
II资料显示:“氨气可在纯氧中安静燃烧…”.某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验.
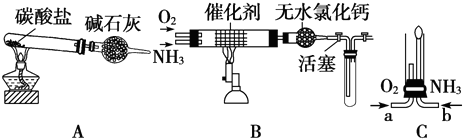
(6)用装置A制取纯净、干燥的氨气,大试管内是碳酸盐;碱石灰的作用是
.
(7)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是
;试管内气体变为红棕色,该反应的化学方程式是
.
(8)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是
,其理由是
.
②氨气燃烧的化学方程式是
.





 (1)按要求写出下列反应方程式:
(1)按要求写出下列反应方程式: