
将0.34 g Cu和CuO的混合物加入约12 mol·L-1浓硫酸中,并加热使其完全溶解,然后用NaOH溶液中和过量硫酸,再用水稀释到0.5 L,加入纯铁粉1.85 g,反应后过滤、干燥,得不溶物1.89 g。求置换出的铜的质量及原混合物中铜的质量分数。
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
已知反应X (g) + Y (g)  n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
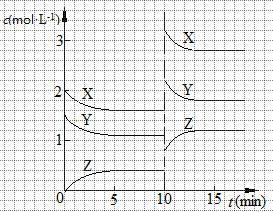
A.反应方程式中n = 1
B.10 min时,曲线发生变化的原因是升高温度
C.10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,用X表示的反应速率为v(X) = 0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:I2+2S2O===S4O+2I-
相关物质的溶度积常数见下表:
| 物质 | CuCl | CuI |
| Ksp | 1.7×10-7 | 1.3×10-12 |
某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是__________________________。
②CuCl2溶液与KI反应的离子方程式为______________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是 ( )
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C. NO2和N2O4 的混合气体中,NO2 的体 积分数是80%
积分数是80%
D. 得到2.54沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,6.72 L NO2通入水后,收集到5.04 L气体,则被氧化的NO2的体积是( )
A.1.68 L B.2.52 L C.0.56 L D.1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
相同体积的NaCl溶液(浓度为C1)和Na2SO4溶液(浓度为C2),若其中的Na+ 物质的量浓度相同,则它们的物质的量浓度C1和C2的关系是 ( )
A.C1 >C2 B.C1 =C2 C.C1 <C2 D.2 C1 =C2
查看答案和解析>>
科目:高中化学 来源: 题型:
将浓度都为1mol/L的Na2CO3溶液和稀H2SO4按体积比2:1混合,则下列说法正确的是
A.混合溶液的pH<7
B.混合溶液中:c(SO42-)+c(OH-)< c(HCO3-)+c(H2CO3)+c(CO32-)
C.混合溶液中:c(Na+)+c(H+)<2[c(SO42-)+c(CO32-)]
D.混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(SO42-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
反应3A(g)+B(g) 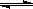 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v (A)=0.15 mol·L-1·s-1 B.v (B)=0.3 mol·L-1·s-1
C.v (C)=0.5 mol·L-1·s-1 D.v (D)=0.4 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com