
| A. | ①⑤⑥⑨ | B. | ④⑥⑦⑧ | C. | ④⑥⑦⑨ | D. | ③④⑥⑦ |
分析 影响化学反应速率的主要因素是反应物本身的性质,其次是外界因素,有温度、浓度、压强、催化剂以及固体的接触面积、光照等等,并且只有存在气体的反应,压强的变化才会影响化学反应速率,另外,形成原电池也能加快反应速率,据此分析.
解答 解:①Fe在浓硫酸中钝化,不能生成氢气,故错误;
②决定化学反应速率的主要因素是反应物的性质,故错误;
③向稀硫酸中加入硝酸钾,硝酸根与氢离子的组合具有强氧化性,与Zn反应不再生成氢气,故错误;
④NO与CO都是气体,减小压强反应速率减慢,故正确;
⑤没有气体参与的反应,压强的改变不影响反应速率,故错误;
⑥加入硫酸铜能够形成锌铜原电池,加快反应速率,故正确;
⑦催化剂能够降低反应的活化能,活化分子百分数增大,反应速率加快,故正确;
⑧氢气与氯气在光照条件下反应生成氯化氢,故正确;
⑨1min内的平均反应速率为:v(NH3)=v(NO)=$\frac{\frac{0.12mol}{2L}}{1min}$=0.06mol/(L•min),但1min末的化学反应速率较慢,故错误;
故选B.
点评 本题考查了影响化学反应速率的因素,主要从内因和外因考虑,注意硝酸根与氢离子的组合具有强氧化性为易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论不正确的是( )
A.由C(s,石墨)═C(s,金钢石) △H>0可知,金刚石比石墨稳定
B.CO(g)燃烧热是283.0kJ•mol﹣1,则2CO2(g)═2CO(g)+O2(g)△H=+566.0kJ•mol﹣1
C.CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,该反应的化学能可以转化为电能
D.已知C(s)+O2(g)═CO2(g)△H1,C(s)+ O2(g)═CO(g)△H2,则△H1<△H2
O2(g)═CO(g)△H2,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
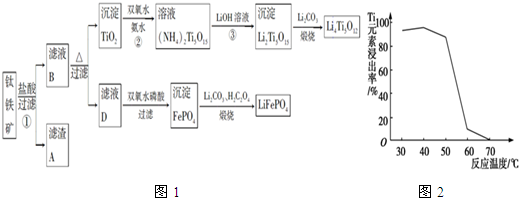
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
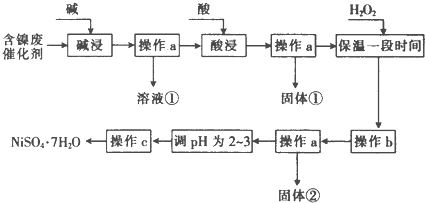
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 现象 | 结论 |
| A | 将足量的乙烯通入到溴水中 | 溴水褪色 | 乙烯与溴水反应生成无色物质 |
| B | 往CaCl2溶液中通入足量的CO2 | 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | 将铜板电路投入FeCl3溶液中 | 铜溶于FeCl3溶液 | 氧化性:Fe3+>Cu2+ |
| D | 取久置的Na2O2粉末,向其中滴加足量的盐酸 | 产生无色气体 | Na2O2已变质为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的相对分子质量相同,互称同分异构体 | |
| B. | 糖类、油脂、蛋白质都属于天然高分子化合物 | |
| C. | 油脂在酸性条件下和碱性条件下都可以水解,且水解产物均相同 | |
| D. | 在允许加热的条件下,可以用氢氧化铜鉴别葡萄糖、乙酸、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
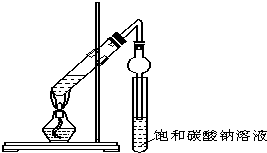 某同学用下图所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
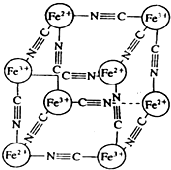 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )| A. | 该晶体是离子晶体 | |
| B. | M的离子位于上述晶胞面心,呈+2价 | |
| C. | 晶体的化学式可表示为MFe2(CN)6,且M为+1价 | |
| D. | M的离子位于上述晶胞体心,呈+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸馏 | |
| B. | 先加入烧碱溶液,之后蒸馏出乙醛;再加入浓硫酸,蒸馏出乙酸 | |
| C. | 加入Na2CO3后,通过萃取的方法分离 | |
| D. | 利用银镜反应进行分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com