
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeI2 | I2 | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | O2 | Mn2+ |
| A. | 表中①组的反应中氧化产物一定是I2 | |
| B. | 氧化性强弱的比较:KClO3>Cl2>Fe3+>I2 | |
| C. | 表中②组每生成1molCl2,转移1mol电子 | |
| D. | 表中③组其他反应物可以为浓盐酸 |
分析 ①过量的氯气与碘化亚铁反应为2FeI2+3Cl2═2FeCl3+2I2,Cl元素化合价降低,被还原,Fe、I元素化合价升高,被氧化,
②KClO3+6HCl═KCl+3Cl2↑+3H2O,KClO3中Cl元素化合价降低,被还原,HCl中Cl元素化合价升高,被氧化,
③5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O,Mn元素化合价降低,被还原,O元素化合价升高,被氧化,结合氧化还原反应的有关概念解答该题.
解答 解:A.表中①组的反应中氧化产物是FeCl3和I2,故A错误;
B.氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则氧化性强弱的比较:KClO3>Cl2>Fe3+>I2,故B正确;
C.KClO3+6HCl═KCl+3Cl2↑+3H2O,KClO3中Cl元素化合价从+5价降低到0价,转移5个电子,则每生成1molCl2,转移$\frac{5}{3}$mol电子,故C错误;
D.KMnO4能氧化浓盐酸,所以不能用浓盐酸酸化,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,明确元素化合价变化是解本题关键,知道常见元素化合价,知道元素性质与化合价的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 18g D2O含有的电子数为10NA | |
| C. | 在标准状况下,22.4LSO3的物质的量为1mol | |
| D. | 同温、同压下,相同体积的氟气和氩气所含的原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图表示为配制一定物质的量浓度稀硫酸时的操作 | |
| B. |  如图表示为配制一定物质的量浓度的溶液定容时的操作 | |
| C. | 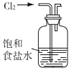 用如图所示装置吸收氯气中的氯化氢气体 | |
| D. | 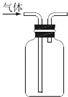 用图所示装置收集一氧化氮气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
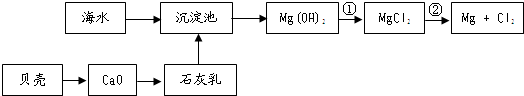
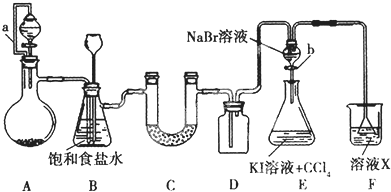
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA | NaOH | 混合后溶液的pH |
| 甲 | C(HA)=0.2mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=a |
| 乙 | C(HA)=c1mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=7 |
| 丙 | C(HA)=0.1mol•L-1 | C(NaOH)=0.1mol•L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
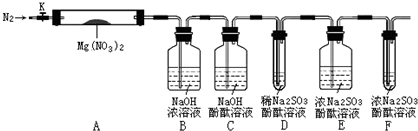
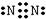 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
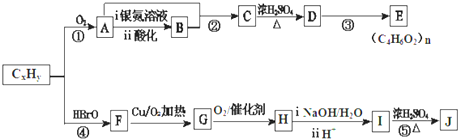

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com