
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
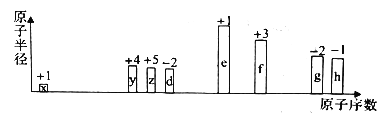
A. 离子半径的大小顺序:d
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
【答案】C
【解析】从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。A.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,故A错误;B.常温下,水为液体,甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点高于甲烷,故B错误;C. 除去实验后试管中残留的硫单质,可用热的氢氧化钠溶液洗涤,反应的方程式为6NaOH+3S=2Na2S+Na2SO3+3H2O,故C正确;D. S、Cl的氧化物对应的水化物的酸性不一定满足h>g,如次氯酸为弱酸,硫酸为强酸,故D错误;故选C。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W的最简单氢化物甲是一种能使湿润的红色石蕊试纸变蓝的无色气体,常用作制冷剂,Y的金属性是所有短周期主族元素中最强的,Z与X属于同一主族,Z与Y属于同一周期。
(1)元素W在周期表位置_______________;
(2)元素W的另一常见氢化物乙是一种高能燃料,为18电子微粒,乙的结构式为___________;
(3)X、Y、Z的原子半径由小到大为______________________;
(4)若X与Z的最外层电子数之和是W核外电子数的2倍,甲可与Z单质发生置换反应,产物之一可作化肥,其反应的化学方程式为_______________,该产物化肥中含有的化学键有______________________。
(5)若由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。则元素Z是____元素,反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式为3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A.反应中MnO2是氧化剂
B.该反应属于复分解反应
C.KClO3在反应中失去电子
D.反应中每生成l mol K2MnO4 , 氧化剂得到2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.溴乙烷和乙烷都是饱和烃
B.甲烷和乙烯都可以与氯气反应
C.高锰酸钾酸性溶液可以氧化苯和甲烷
D.乙烯可以与氢气发生加成反应,苯不能与氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH。
CH3OH(g) ΔH。
(1)能判断反应达到平衡状态的依据是__________(填字母序号)。
A.2 ν逆(H2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
F、CO、H2、CH3OH的速率之比为1:2:1
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H_______0(填“>”或“<”)。

(3)一定温度下,将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为_______________。
②若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是_______________(“正向移动”“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的![]() ,与原平衡相比,下列有关说法正确的是_____________(填字母)。
,与原平衡相比,下列有关说法正确的是_____________(填字母)。
A.H2的浓度减小; B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加; D.重新平衡时, ![]() 增大;
增大;
(4)上图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A_________ C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_________ C,由状态B到状态A,可采用_____________的方法(填“升温”或“降温”)。
(5)如图是一定的温度和压强下![]() 和
和![]() 反应生成1 mol
反应生成1 mol ![]() 过程中能量变化示意图,请写出工业合成氨的热化学方程式__________________
过程中能量变化示意图,请写出工业合成氨的热化学方程式__________________![]() H的数值用含字母
H的数值用含字母![]() 、Q
、Q![]() 的代数式表示)。
的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由以下粒子结构示意图得出的结论正确的是( ) 
A.④表示的是阳离子
B.①③属于同种元素,②④属于另一种元素
C.②④形成的化合物是Al2O3
D.①③的化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为:锌片:Zn+20H--2e-=ZnO+H20 石墨:02+2H20+4e-=40H-根据此判断,锌片是
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的前四周期元素,A是周期表中原子半径最小的元素,它们组成的单质或化合物有如图转化关系,其中甲、丙和戊是单质,乙、丁和己是氧化物,其中丁是两性氧化物,戊是紫红色金属。请回答下列问题:

(1)D元素的元素符号为______________,C元素在周期表中的位置为_____________。
(2)用电子式表示己的形成过程_____________。
(3)反应①在工业生产中通常称作_____________反应。
(4)甲、戊与浓硝酸可形成原电池,其中________________(填化学式)作负极,正极电极反应式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com