
科目:高中化学 来源: 题型:
B.[实验化学]
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是__________________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、____________________和__________________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.核能、太阳能、生物质能、风能、氢能均属于新能源
C.自发反应的熵一定增大,非自发反应的熵一定减小
D.常温下,反应C(s)+CO2(g) 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积为1 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的平衡常数表达式K=__________,升高温度,化学平衡向__________
(填“正反应”或“逆反应”)方向移动。
(2)能判断该反应达到化学平衡状态的依据是________。
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(H2)=v正(CO2) E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温
度为_____;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol
CO、1.5 mol H2O,则此时反应朝______方向进行(填“正反应”、“逆反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明CuSO4溶液显蓝色不是由于SO42-离子造成的,下列实验无意义的是( )。
A.观察K2SO4溶液的颜色
B.向CuSO4溶液中滴加适量的NaOH溶液,振荡后静置,溶液颜色消失
C.向CuSO4溶液中滴加适量的Ba(NO3)2溶液,振荡后静置,溶液颜色未消失
D.加水稀释后CuSO4溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl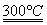 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是_________________________。
装置C中的烧瓶需要加热,其目的是_____________________________________。
②反应一段时间后,装置D中观察到的现象是______________________________________,装置D不能采用普通玻璃管的原因是____________________________________,装置D中发生反应的化学方程式为__________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_________________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是对日常生活中常见的一些做法的解释或现象的描述,其中正确的是
①生产面粉的工厂车间应“严禁烟火”:面粉颗粒很小,悬浮在空气中的单位质量的面粉与O2的接触面积大,遇到明火易发生爆炸
②使用冰箱贮存食物可延长食物保鲜期:冰箱内气温较低,微生物的生长、繁殖速率慢
③镀锡铁桶在镀层破损后破损处很快会出现破洞
④铝比铁性质活泼得多,但铝制品比铁制品耐腐蚀得多:铝表面能形成致密的氧化物保护膜
⑤用酒精擦拭皮肤后,相应部位有清凉感:酒精具有消毒杀菌能力
A.①②③④⑤ B.①②③④ C.①②④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④.。。。。。。。。
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
装置A中反应的化学方程式为——————
第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是——————
操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)——
装置B中的冷水作用为——————;装置C的名称为————;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:——
在虚线框内画出尾气吸收装置E并注明试剂
II.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
FeCl3与H2S反应的离子方程式为——————————————————
电解池中H+再阴极放电产生H2,阳极的电极反应为————————
综合分析实验II的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②——————————————————
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com