
【题目】下列物质的分子中存在碳碳双键的是
A.乙烷B.乙烯C.乙炔D.乙醇
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:

(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)元素⑦与⑧的原子半径大小关系是:⑦______⑧(填“>”或“<”)。
(3)④⑤两元素相比较,金属性较强的是______ (填元素名称)。
(4)元素①的最高价氧化物的水化物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:

已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深蓝色);③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为________。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为________________________。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是___________。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响

(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4·H2O的实验、操作为___________。

(4)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案: ____________________________(实验中须使用的试剂有:30%双氧水,0.001 mol·L-1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究氰化物的性质:已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
25℃电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
(1)NaCN溶液呈碱性的原因是________________________ (用离子方程式表示)
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是_________

A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN﹣+CO2+H2O=HCN+CO32﹣
C.图像中a点酸的总浓度小于b点酸的总浓度
D.c点溶液的导电性比a点溶液的导电性弱
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为_____。
(4)下列四种离子结合H+能力由弱到强的是______________________________________。
A. HCOO- B. CN- C. CO32- D.HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g) + O2(g) ![]() 2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前5 min的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g)时,υ正> υ逆
C. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为40%
D. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了延长水果的保鲜期,下列的水果存放方法最合适的是
A.放入敞口的容器中 B.放入浸泡过高锰酸钾溶液硅土的密封容器中
C.放入密封的容器中 D.放入充有少量乙烯的密封容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是( )
A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
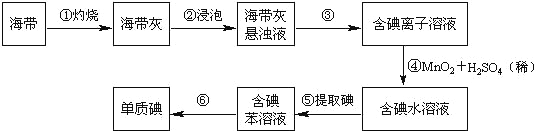
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com