
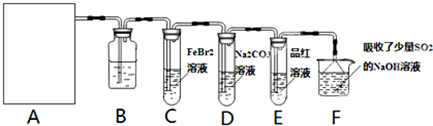
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,反应物状态为固体与液体,据此判断需要仪器;
(2)浓盐酸具有挥发性,加热能够促进浓盐酸的挥发,所以制取的氯气中含有氯化氢和水蒸气,依据二者性质选择除杂试剂;
(3)氯气具有很强的氧化性,能够和具有较强还原性的Fe2+发生反应;FeBr2与Cl2发生氧化还原反应,溴化亚铁中的二价铁先被氧化;
(4)①次氯酸具有强的氧化性,亚硫酸根离子具有强的还原性,二者发生氧化还原反应;
②酸性环境下,高锰酸钾具有强的氧化性,能够氧化亚硫酸根离子;
③次氯酸根离子在酸性环境下具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝.
解答 解:(1)二氧化锰和浓盐酸反应制取氯气的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,从方程式可知该反应需加热,需酒精灯,反应物浓盐酸的滴加以及防氯气的逸出需分液漏斗;
故答案为:分液漏斗、酒精灯;
(2)浓盐酸具有挥发性,加热能够促进浓盐酸的挥发,要制取纯净干燥的氯气应依次除去氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以选择饱和食盐水除去氯气;
故答案为:饱和食盐水;吸收氯气中的氯化氢;
(3)若E中品红溶液褪色,说明经过E中有氯气,经过E中有氯气说明C装置中,溴化亚铁中的二价铁和溴离子均被氧化;因FeBr2与Cl2发生氧化还原反应,溴化亚铁中的二价铁先被氧化,所以只须证明有三价铁存在即可,KSCN溶液可与三价铁形成血红色的硫氰化铁可证明有三价铁存在,另取少量C中溶液,加入CCl4萃取,CCl4层变为橙色,证明有溴单质生成;
故答案为:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2;滴加KSCN溶液,溶液变为血红色;另取少量C中溶液,加入CCl4萃取,CCl4层变为橙色;
(4)①次氯酸具有强的氧化性,亚硫酸根离子具有强的还原性,二者发生氧化还原反应,所以二者不能共存;
故答案为:SO32-与ClO-能发生氧化还原反应,故不能共存;
②酸性环境下,高锰酸钾具有强的氧化性,能够氧化亚硫酸根离子,若看到溶液褪色,即可证明亚硫酸酸根离子的存在;
故答案为:ab;褪色;
③次氯酸根离子在酸性环境下具有强的氧化性,能够氧化碘离子生成单质碘离子方程式:ClO-+2I-+2H+=I2+Cl-+H2O,碘遇到淀粉变蓝;
故答案为:ad;变蓝色; ClO-+2I-+2H+=I2+Cl-+H2O.
点评 本题为综合题,设计氯气的制备、性质的检验,解题关键在于熟悉氯气制备原理、氯气性质,题目难度中等,注意实验设计的严密性.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含有的质子数为8NA | |
| B. | 12 g金刚石中含有的碳原子数为4NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑥ | C. | ③④⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| C | D | E | |||||
| F | G | H | I | J | K |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
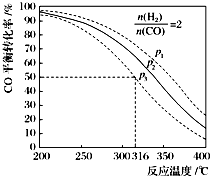 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com