
| A. | 金属性:Na>Mg>Al | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 碱性:NaOH<Mg(OH)2<Al(OH)3 |
分析 A.同一周期,自左到右,金属性逐渐减弱;
B.Mg的最外层为全充满状态;
C.同一周期,自左到右,电负性逐渐增强;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:A.同一周期,自左到右,金属性逐渐减弱,因此金属性Na>Mg>Al,故A正确;
B.同周期元素从左到右,第一电离能逐渐增大,但Mg的最外层为全充满状态,电子能量最低,第一电离能Mg>Al>Na,故B错误;
C.同一周期,自左到右,电负性逐渐增强,因此电负性Na<Mg<Al,故C错误;
D.因金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强故碱性NaOH>Mg(OH)2>Al(OH)3,故D错误;
故选A.
点评 本题考查同周期元素的性质的递变规律,题目难度不大,本题注意第一电离能的变化规律,为该题的易错点,答题时要注意把握.


科目:高中化学 来源: 题型:选择题
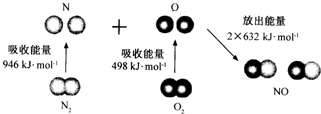
| A. | N2 (g)和O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 molO原子结合生成O2(g)时需要吸收498kJ能量 | |
| C. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444kJ•mol-1 | |
| D. | 1molNO(g)分子中的化学键断裂时需要吸收632kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al--Al2O3--Al(OH)3--NaAlO2 | B. | Fe--FeO--Fe(OH)2--Fe(OH)3 | ||
| C. | S--SO3--H2SO4--MgSO4 | D. | Na--Na2O2--Na2CO3--NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2 | B. | H2SO4 | C. | NaOH | D. | Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于电流的作用,酸、碱、盐溶于水发生电离 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧、活性炭处理水的原理相同 | |
| B. | 氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制各种化学试剂 | |
| C. | 氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率 | |
| D. | 漂白粉长期露置在空气中会失效 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com