
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。

(1)写出下列物质的化学式:D___________,X_______________。
(2)在反应①~⑦中,不属于氧化还原反应的是_____________(填编号)。
(3)反应⑥的离子方程式为:______________________________________。
(4)往G溶液中加入NaOH溶液观察到的现象是________________________。
(5)反应⑦的化学方程式为____________________________________;该反应中每消耗0.3mol的A,可转移电子________mol。
(6)除去D溶液中混有的少量G的化学方程式:_________________。
【答案】FeCl3 HCl ③⑥ Fe3++3SCN-=Fe(SCN)3 生成白色沉淀,迅速变为灰绿色,最终变为红褐色 3Fe+4H2O(g)![]() Fe3O4+4H2 0.8 2Fe2++Cl2=2Fe3++2Cl-
Fe3O4+4H2 0.8 2Fe2++Cl2=2Fe3++2Cl-
【解析】
单质A和C反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中DG之间可以实现相互转化,说明A为变价金属Fe,和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,依据D+A=G说明D为含三价铁离子的化合物,F为含SCN-离子的化合物,G为含Fe2+离子的化合物,H为H2O;依据G+B=D分析判断B是强氧化剂,B为黄绿色气体,证明为Cl2,所以推断D为FeCl3,得到G为FeCl2,X为HCl;依据判断出的物质回答问题。
根据以上分析可知A为金属Fe,B为Cl2,C为O2,D为FeCl3,E为Fe3O4,F为含SCN-离子的化合物,G为FeCl2,H为H2O,X为HCl;则
(1)依据分析推断可知,D为FeCl3,X为HCl;
(2)依据反应过程分析,①为铁和氯气发生的氧化还原反应,②为铁和氧气发生的氧化还原反应,③为四氧化三铁和盐酸发生的反应,不是氧化还原反应,④为氯化铁和铁发生的氧化还原反应,⑤为氯化亚铁和氯气发生的氧化还原反应,⑥是氯化铁和SCN-发生的反应,不是氧化还原反应,⑦为铁和水蒸气发生的氧化还原反应生成四氧化三铁和氢气,则在反应①~⑦中,不属于氧化还原反应的是③⑥;
(3)反应⑥是氯化铁和SCN-发生的反应,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3;
(4)往G为FeCl2溶液中加入NaOH溶液观察到的现象是,生成白色氢氧化亚铁沉淀,被空气中氧气氧化为氢氧化铁,现象为生成白色沉淀,迅速变为灰绿色,最终变为红褐色;
(5)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;该反应中氢元素化合价从+1价变化为0价,4mol水反应转移电子为8mol,消耗3mol铁,则每消耗0.3mol的Fe,可转移电子0.8mol。
Fe3O4+4H2;该反应中氢元素化合价从+1价变化为0价,4mol水反应转移电子为8mol,消耗3mol铁,则每消耗0.3mol的Fe,可转移电子0.8mol。
(6)氯化亚铁易被氯气氧化为氯化铁,则除去FeCl3溶液中混有的少量FeCl2的方法是向混合溶液中通入足量的氯气,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
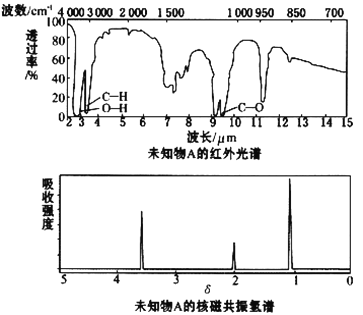
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1:2:3
C. 仅由其核磁共振氢谱可知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列关于氯气的实验装置能达到实验目的的是
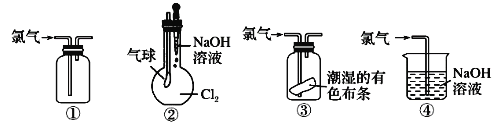
①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A. ①② B. ①③ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。

完成下列填空:
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为: 、
。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
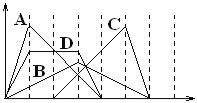
A. 向NaAlO2溶液中滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的A1C13溶液中滴入NaOH溶液至过量。
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水常用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的药品变质问题的是 ( )
A. AgNO3 B. FeCl2
C. NaHSO3 D. NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐的化学式为( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化还原滴定的基准物。下面是制取莫尔盐的部分装置与实验步骤:
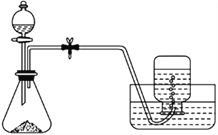
①将铁屑放入小烧杯中,加适量的Na2CO3溶液,小火加热几分钟,倒掉溶液后,用蒸馏水洗净铁屑,晾干。
②在锥形瓶中加入2.24 g 铁屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,过滤。在滤液中加入一定量的乙醇,待晶体析出后,过滤、洗涤、晾干,得莫尔盐晶体。
请回答下列问题:
(1)实验开始前,检查反应器气密性的方法为_____________________。
(2)步骤①中Na2CO3溶液的作用是_____________________________________。
(3)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步骤③中理论上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g铬青铜样品,将其中的铬氧化为H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用浓度为0.0180 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.75 mL。已知弱酸H2CrO4被还原为Cr3+,则滴定时反应的离子方程式为_____________________________________。该样品中铬元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研究锂硫电池获得突破,电池的总反应是16Li+S8 ![]() 8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
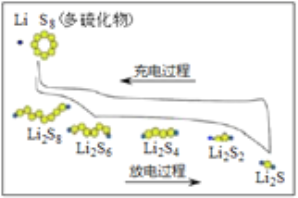
A. 充电时,电能转化为化学能
B. 放电时,锂离子向正极移动
C. 放电时,1mol Li2S6转化为Li2S4得到2mole-
D. 充电时,阳极总电极反应式是8S2- -16e- = S8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若某原子在处于能最最低状态时,外围电子排布为4d15s2,则下列说法正确的是___(填标号)
A.该元戴原子处于能量最低状态时,原子中共有3个未成对电子
B.该元载原子核外共有5个电子层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层其有3个电子
(2)下列说法正确的是_______(填标号)
A.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
B.H2O是一种非常稳定的化合物,这是由于氢键所致
C.H2O分子中两个O-H键的键角为180°
D.所有分子中都含有共价键
(3)根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为____(填标号)
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com