
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:Cu(OH)2+4NH3![]() [Cu(NH3)4]2+2OH-
[Cu(NH3)4]2+2OH-
平衡Ⅱ:Cu(OH)2+2OH-![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mg·L-1 | 72 | ≤0.5 |
Nh4+/mg·L-1 | 2632 | ≤15 |
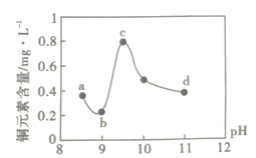
下列说法错误的是( )
A.a~b段发生的反应为:Cu2++2OH-=Cu(OH)2↓
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
【答案】B
【解析】
滴加NaOH(aq)的过程中依次发生过些Ⅰ:2OH-+Cu2+=Cu(OH)2(a>b):过程Ⅱ:NH4++OH-=NH3+H2O2NH3使平衡Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-正向移动(b→c);过程Ⅲ:继续滴加,OH-便Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH游向移动(e→d)若NaOH继续过量滴加可使Cu(OH)2+2OH=[Cu(OH)4]2正向移动(d点之后)。
A、图象中的变化曲线可知PH=9时铜离子浓度最小,废水中Cu2+处理的最佳pH约为9,故A正确;
B、b~c段随氢氧根离子浓度增大,铵根离子与氢氧根离子结合生成一水合氨,氨气浓度增大,Cu(OH)2+4NH3=[Cu(NH3)4]2++20H-,平衡正向进行,溶液中通过离子浓度增大,故B错误;
C、c~d段,随氢氧根离子浓度的增大,Cu(OH)2+4NH3=[Cu(NH3)4]2++20H-逆向进行,铜离子浓度减小,铜元素含量下降,故C正确;
D、d点以后,随c(OH-)增加,平衡II:Cu(OH)2+2OH-=[Cu(OH)4]2-正向进行,上层清液中铜元素的含量可能上升,故D正确;
故答案为:B。


科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-![]() 2AlO2-+H2↑
2AlO2-+H2↑
C. 室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______________________.
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为______杂化,在有机物中C原子间可以形成双键,而硅烷中Si原子间难以形成双键的原因是_____________.
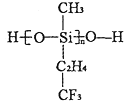
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
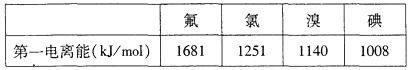
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________(填元素符号)
②根据价层电子对互斥理论,预测ClO的空间构型为___________形,写出一个ClO的等电子体的化学符号___________.
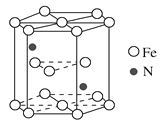
(4)海底金属软泥是在洋海底蕴藏着大量的资源,含有硅、铁、锰、锌等。某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为________________,若晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为________g·cm3(用含a、c和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态Ni2+的价层电子轨道表达式为________,C、N、O的第一电离能从小到大的顺序为________。
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO2+、PCl6-等。
①(CH3)3NH+ 中N原子的杂化类型为___,NO2+的空间构型为______________。
②PCl5是一种白色固体,在加压下于148℃时液化,形成一种能导电的熔体。熔体能导电的原因是___________。
(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为______,Ni(CO)4熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,Ni(CO)4为______晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO_____NiO(填“>”、“<”或“=”)。
② FeO 晶胞如下图,Fe2+的配位数为_______。
③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为g·cm-3,则x=_______。
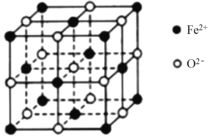
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子B. ClO3-的立体构型为平面三角形
C. NH3和BF3的立体构型均为平面三角形D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质:①石墨;②水银;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧冰酷酸(CH3COOH);⑨氧化钠固体; ⑩液态氯化氢。
(1)其中能导电的是_________; 属于非电解质的是_________; 属于电解质的是____________
(2)等质量④和⑤中氢原子的数目之比为_____; 若④和⑤中所含氢原子数相等, 在相同条件下④和⑤的体积之比为____________
(3)向⑥中加入少量⑦请写出离子方程式:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产中应用广泛。
Ⅰ.某同学设计如下实验装置测定铜的相对原子质量(夹持和加热仪器已略去),并检验氯气的氧化性。
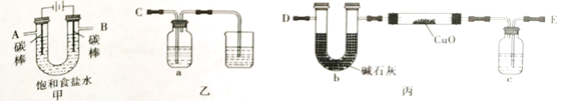
(1)该实验装置的连接顺序为:A连接________,B连接________(填字母)。
(2)乙装置a瓶中的溶液可以是_______
A.NaOH溶液 B.Na2S溶液 C.酸性KMnO4溶液 D.含少量KSCN的FeCl2溶液
(3)对丙装置进行加热前需要________ 。
(4)准确称量 m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为________ (只要求列出算式)。该实验方案的装置有不合理之处,若不加以改正会导致测定结果________(填“偏大”、”偏小“或”不变“)。
Ⅱ.研究发现Cu与稀盐酸不反应,但在持续通入空气的条件下可反应生成CuCl2。
(5)已知Fe3+对该反应有催化作用,其催化原理如图所示:
![]()
则图中的M‘为________(填化学符号)
(6)向CuCl2溶液中通入H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2++H2S=CuS(s)+2H+ , 则该反应的平衡常数K=________(保留一位小数)。已知:CuS溶度积KSP=1.0×10-36 , H2S电离常数Ka1=1.3×10-7 , Ka2=7.0×10-15。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. ![]() σ键和π键比例为7:1
σ键和π键比例为7:1
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C. C22﹣与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA, O22+的电子式可表示为 ![]()
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com