
利用下图装置,写出除去下列气体中的杂质的方法,并写出化学方程式(括号内的气体为杂质).
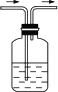
(1)CO2(SO2)________,化学方程式________.
(2)SO2(SO3,假设SO3为气体)________,化学方程式________.
(3)NO(NO2)________,化学方程式________.
科目:高中化学 来源: 题型:阅读理解
| ||
| ||

| ||
| ||
| 20V |
| 7 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
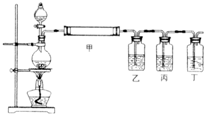
测某种含有少量氧化钠的过氧化钠试样的质量分数。
方法一:利用下图装置测定混合物中Na2O2的质量分数,已知试样质量为1.560g、锥形瓶和水的质量为190.720g,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式________________
(2)该试样中过氧化钠的质量分数为____________________(保留3位有效数字)
不必作第6次读数的原因是____________________________________
方法二:测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
(3)操作Ⅱ的名称是________________________
(4)需直接测定的物理量是______________________________
(5)测定过程中需要的仪器有电子天平、蒸发皿、酒精灯、还需要________、_______(固定、夹持仪器除外)
(6)在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果__________________
(填偏大、偏小或不变)。
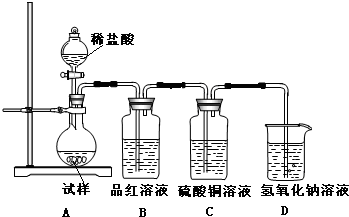
方法三:请从下图中选用适当仪器测定混合物中Na2O2的质量分数,要求操作简单。
除待测试样外,限选试剂:CaCO3固体,6mol/L盐酸和蒸馏水
(7)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)__________________。
查看答案和解析>>
科目:高中化学 来源:2011届辽宁省沈阳二中高三第四次模拟考试(理综)化学部分 题型:实验题
测某种含有少量氧化钠的过氧化钠试样的质量分数。
方法一:利用下图装置测定混合物中Na2O2的质量分数,已知试样质量为1.560g、锥形瓶和水的质量为190.720g,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式________________
(2)该试样中过氧化钠的质量分数为____________________(保留3位有效数字)
不必作第6次读数的原因是____________________________________
方法二:测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
(3)操作Ⅱ的名称是________________________
(4)需直接测定的物理量是______________________________
(5)测定过程中需要的仪器有电子天平、蒸发皿、酒精灯、还需要________、_______(固定、夹持仪器除外)
(6)在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果__________________
(填偏大、偏小或不变)。
方法三:请从下图中选用适当仪器测定混合物中Na2O2的质量分数,要求操作简单。
除待测试样外,限选试剂:CaCO3固体,6mol/L盐酸和蒸馏水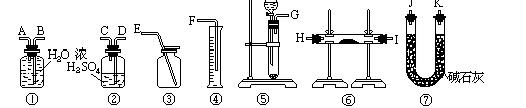
(7)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)__________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省高三第四次模拟考试(理综)化学部分 题型:实验题
测某种含有少量氧化钠的过氧化钠试样的质量分数。
方法一:利用下图装置测定混合物中Na2O2的质量分数,已知试样质量为1.560g、锥形瓶和水的质量为190.720g,每隔相同时间读得电子天平的数据如表:

(1)写出Na2O2和H2O反应的化学方程式________________
(2)该试样中过氧化钠的质量分数为____________________(保留3位有效数字)
不必作第6次读数的原因是____________________________________
方法二:测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:

(3)操作Ⅱ的名称是________________________
(4)需直接测定的物理量是______________________________
(5)测定过程中需要的仪器有电子天平、蒸发皿、酒精灯、还需要________、_______(固定、夹持仪器除外)
(6)在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果__________________
(填偏大、偏小或不变)。
方法三:请从下图中选用适当仪器测定混合物中Na2O2的质量分数,要求操作简单。
除待测试样外,限选试剂:CaCO3固体,6mol/L盐酸和蒸馏水
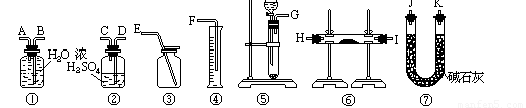
(7)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com