
| A. | 氢氟酸显弱酸性,可用于雕刻玻璃 | |
| B. | NaClO溶液显碱性,可用于杀菌消毒 | |
| C. | NH4Cl分解时吸收大量的热,可用作阻燃剂 | |
| D. | CO2密度比空气大,可用作镁着火时的灭火剂 |
分析 A.氢氟酸能够与玻璃中的二氧化硅反应生成四氟化硅和水;
B.次氯酸根具有强的氧化性而具有漂白性;
C.大多数分解反应吸收热量;
D.二氧化碳与镁反应生成氧化镁和碳.
解答 解:A.氢氟酸能够与玻璃中的二氧化硅反应生成四氟化硅和水,可用于雕刻玻璃,与氢氟酸的弱酸性无关,故A错误;
B.NaClO溶液可用于杀菌消毒,是因为次氯酸根在的强氧化性,故B错误;
C.NH4Cl分解时吸收大量的热,可用作阻燃剂,故C正确;
D.二氧化碳与镁反应生成氧化镁和碳,所以镁可以在二氧化碳中燃烧,故D错误;
故选:C.
点评 本题综合考查元素化合物知识,为高频考点,熟悉相关物质的性质及用途是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 锅炉中的水垢中含硫酸钙,可先用碳酸钠溶液处理,再用酸去除 | |
| C. | 实验室可用排饱和食盐水的方法收集氯气 | |
| D. | 钢铁在潮湿的空气中容易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L酒精中含有的分子数目为NA | |
| B. | 常温常压下,l.mol/L盐酸中含有的氯离子数目为NA | |
| C. | 常温常压下,24gO2和24gO3含有的氧原子数目都为1.5NA | |
| D. | 标准状况下,2.24L氯气与足量NaOH溶液反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器体积/L c(Y)/(mol•L-1) 温度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
| A. | m+n>p | |
| B. | Q<0 | |
| C. | 体积不变,温度升高,平衡向逆反应方向移动 | |
| D. | 温度不变,压强增大,Y的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠可用于治疗胃酸过多 | |
| B. | 用氯化钡溶液可鉴别SO42-和CO32- | |
| C. | CO、NO、NO2都是大气污染物 | |
| D. | 常温下,可用铝制或铁制槽车运输浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

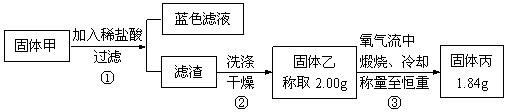
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com