
下列各溶液中,物料的物质的量浓度关系正确的是( )
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性c(CH3C00-)>c(Cl-)>c(H+)>c(CH3COOH)
B.已知酸性HF>CH3COOH, 则pH相等的NaF与CH3COOK溶液中:
[c(Na+)―c(F-)]=[c(K+)―c(CH3COO-)]
C.0.1mol/L的醋酸的PH=a, 0.01mol/L的醋酸PH=b,则a+1=b
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
C(NH4Cl)<c[(NH4)2CO3]<c[(NH4)2SO4]
![]()
科目:高中化学 来源: 题型:
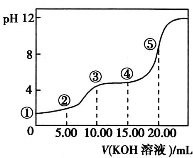 室温下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4溶液所得的滴定曲线如图所示(混合溶液的体积可看成混合前两溶液的体积之和).请回答下列问题:
室温下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4溶液所得的滴定曲线如图所示(混合溶液的体积可看成混合前两溶液的体积之和).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com