
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
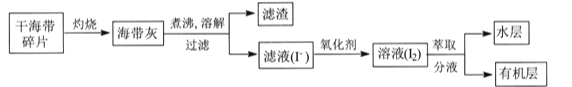
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
【答案】C
【解析】
实验室从海带中提取碘:将海带在坩埚中灼烧得到海带灰,将海带灰浸泡得到海带灰悬浊液,然后采用过滤的方法将残渣和溶液分离,得到含有碘化钾的溶液,向水溶液中加入氧化剂,将I-氧化成I2,向含有碘单质的溶液中加入萃取剂萃取分液得到碘单质的有机溶液,据此分析解答。
A.海带在坩埚中灼烧得到海带灰,有机物燃烧生成二氧化碳和水,过滤操作主要除去海带灰中难溶于水的固体,主要是无机物,故A正确;
B.氧化剂可以选用过氧化氢溶液,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,故B正确;
C.萃取过程所用有机溶剂可以是四氯化碳或苯,不能选用酒精,因为酒精易溶于水,故C错误;
D.因I2易升华,有机溶剂的沸点一般较低,因此I2的有机溶液通过蒸馏法难以彻底分离,故D正确;
故选C。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。反应原理为:

实验步骤如下:
步骤1:在三颈瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器b(反应装置如图)。
步骤2:缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3:等酯化到一定程度时,升温至150℃
步骤4:冷却,将三颈瓶中的液体倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5:减压蒸馏,收集200~210℃2666Pa馏分,即得DBP产品
(1)浓硫酸的作用______________________,搅拌器的作用______________________。
(2)反应过程中正丁醇过量的目的是___________________________________________。

(3)图中仪器a的名称是分水器,试分析它的作用是_____________________________。
步骤3中确定有大量酯生成的依据是_______________________________________。
(4)碳酸钠溶液洗涤的目的是_________________________________________________。
用减压蒸馏的目的是_____________________________________________________。
(5)写出正丁醇在135℃生成醚的反应方程式___________________________________。
写出DBP在氢氧化钠溶液中水解的方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在生产和生活中有重要意义。海水中CO2的吸收能力取决于溶解的碳酸盐和硼酸盐生成的CO32-和B(OH)4-浓度。已知:298K时,H3BO3+H2O![]() H++B(OH)4-,Ka=5.7×10-10,碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
H++B(OH)4-,Ka=5.7×10-10,碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
(1)298K时,相同浓度的碳酸钠溶液和硼酸钠溶液,pH较大的是_______溶液。
(2)少量CO2与B(OH)4-反应的离子方程式为___________。
(3)采用高温熔融混合碳酸盐LiaNabKcCO3作电解质吸收并电解CO2制得无定型炭是CO2 资源化利用的一种新途径。此法的阴极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用氨碱法制取碳酸钠的原理,在实验室设计下列模拟装置制备NaHCO3(铁架台、C装置水浴中的温度计、酒精灯等略去),然后再制取Na2CO3。提供的试剂有:硫酸、盐酸、石灰石、浓氨水、碳酸氢钾溶液、水、生石灰、食盐等。
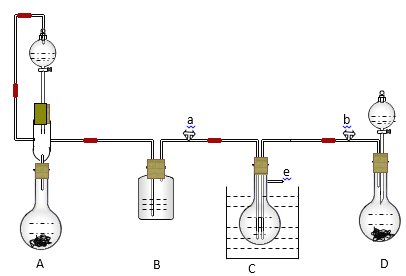
(1)在A中分液漏斗和烧瓶中加入的试剂分别是________、_________;D中分液漏斗和烧瓶中加入的试剂分别为______、________;
(2) B中加入的试剂是______________, 作用是________________________________。
(3)写出C中生成的NaHCO3化学方程式:____________________________________________。
(4)装置A中分液漏斗上方装一导管的主要作用是____________________________________。
(5)实验开始a、b两活塞的正确操作应是(选填序号)_______。
①同时打开a、b两活塞 ②先打开a,后打开b ③先打开b,后打开a
(6)检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是____________________。
(7)由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、_____。
(8)从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源,改进的方法是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中2 mol NO与1 mol O2充分反应,产物分子的数目为2NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA
C.标准状况下,22.4 L CCl4含CCl4分子数为NA
D.标准状况下,22.4L N2与CO混合气体的质量为28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
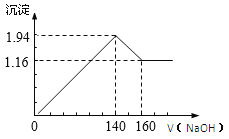
求:(1)合金中Mg,Al的质量_______________;
(2)所用HCl的物质的量浓度_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子化合物G的合成路线如图:(部分产物及反应条件已略去)
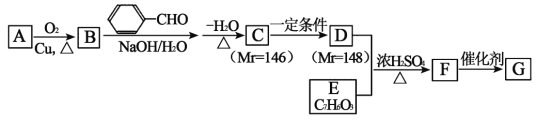
已知:①2RCH2CHO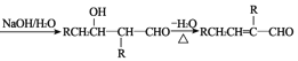
②E遇FeCl3溶液呈紫色,且能与NaHCO3溶液反应生成无色气体,其核磁共振氢谱有4组吸收峰。
回答下列问题:
(1)A的名称为___,G的结构简式为___。
(2)A→B的化学方程式为___,该反应的类型为___。
(3)C发生银镜反应的化学方程式为___。
(4)D+E→F的化学方程式为___。
(5)H为D的同分异构体,且H分子中含有(![]() ),苯环上有2个取代基,则H的可能结构有___种(不考虑立体异构),其中,能与新制氢氧化铜悬浊液反应产生砖红色沉淀且核磁共振氢谱有5组吸收峰的结构简式为___。
),苯环上有2个取代基,则H的可能结构有___种(不考虑立体异构),其中,能与新制氢氧化铜悬浊液反应产生砖红色沉淀且核磁共振氢谱有5组吸收峰的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是___(填元素符号)。
(2)②③⑦三种元素的原子半径从大到小的顺序为___(填元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式___,碱性最强的化合物的名称___。
(4)元素⑤的氧化物与元素④的最高价氧化物对应水化物反应的化学方程式为:___。
(5)元素⑥和⑦形成的气态氢化物较稳定是___(填化学式),用方程式来说明元素⑦的非金属性比⑥的非金属强的事实___(一个或两个方程式均可)。
(6)表示①与③形成的化合物的电子式___,写出它的一种用途___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com