
| A. | 常温下pH=7的溶液中:Fe3+,Mg2+,SO42-,Cl-能大量共存 | |
| B. | 常温下水电离出c(H+)×c(OH-)=10-10的溶液中:Na+,NH4+,CH3COO-,F-不能大量共存 | |
| C. | 在含有HCO3-,HSO3-,CH3COO-,S2-四种阴离子的溶液中加入足够的Na2O2固体后,S2-浓度变化最小 | |
| D. | SO2,O2,HCl,CO2四种气体,可以大量共存于同一容器中 |
分析 A.铁离子在pH为4.4左右沉淀完全;
B.常温下水电离出c(H+)×c(OH-)=10-10的溶液,水的电离受到促进,为水解的盐溶液;
C.加入足够的Na2O2固体后,与水反应生成碱,且具有强氧化性;
D.四种气体常温下不反应.
解答 解:A.铁离子在pH为4.4左右沉淀完全,则pH=7的溶液中不能大量存在Fe3+,故A错误;
B.常温下水电离出c(H+)×c(OH-)=10-10的溶液,水的电离受到促进,为水解的盐溶液,该组离子之间不反应,可大量共存,故B错误;
C.加入足够的Na2O2固体后,与水反应生成碱,且具有强氧化性,则HSO3-、S2-均被氧化,HCO3-与碱反应,CH3COO-离子变化最小,故C错误;
D.四种气体常温下不反应,可大量共存于同一容器中,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{NaOH溶液}{→}$Al2O3 | |
| B. | N2$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{O_{2}、H_{2}O}{→}$HNO3 | |
| C. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-和Cl2均有毒 | B. | Cl-和Cl2均呈黄绿色 | ||
| C. | 相比较,Cl-稳定,Cl2活泼 | D. | Cl-和Cl2均能与金属单质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中的K0H、Cl2和H2都是电解质 | |
| B. | 反应②属于离子反应 | |
| C. | 若反应①消耗7.45gKCl,可以制备标准状况下4.48L氯气 | |
| D. | 反应②中氧化剂和还原剂的质量之比是1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
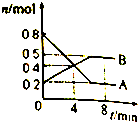 某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,
某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com