
分析 (1)根据恒温恒容,体积之比等于物质的量之比,再利用三段式进行计算;
(2)若乙中W%=40%,说明在恒温恒容条件下,①和②为等效平衡,建立平衡的过程中乙压强有变化,则按化学计量数转化到左边,满足n(A)=4mol、n(B)=2mol,据此计算x.
解答 解:(1)设达平衡时B转化了nmol
2A(g)+B(g)?xC(g),
开始(mol) 4 2 0
转化(mol) 2n n xn
平衡(mol)4-2n 2-n xn
因为C的体积分数为40%,则有$\frac{xn}{4-2n+2-n+xn}$×100%=40%,解得xn=4-2n
所以A的体积分数为=$\frac{4-2n}{4-2n+2-n+xn}$×100%=40%
故答案:40%;
(2)若乙中W%=40%,说明在恒温恒容条件下,①和②为等效平衡,建立平衡的过程中乙压强有变化,则按化学计量数转化到左边,满足n(A)=4mol、n(B)=2mol,故1mol+$\frac{2×3mol}{x}$=4,解得x=2,带入(1)则平衡时A为2mol,B为1mol,C为2mol,所以乙中平衡向逆反应进行,故压强增大;
故答案为:2;递增.
点评 本题考查了化学平衡的计算、等效平衡等,难度中等,注意等效平衡的判断及其应用,有利于提高学生灵活运用基础知识解决实际问题的能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、c (Fe2+)都减小 | |
| D. | 该反应平衡常数 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
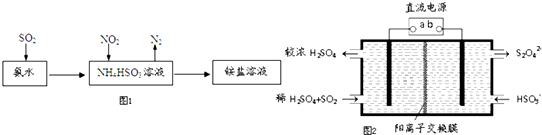 SO2和NOx都是大气污染物.
SO2和NOx都是大气污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
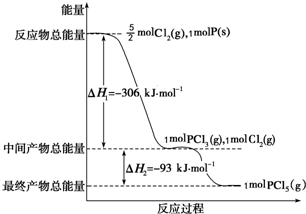 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 待测氢氧化钠溶液体积(mL) | 标准盐酸体积(mL) | NaOH溶液浓度(mol/L) | ||
| 初读数 | 末读数 | 体积 | |||
| 1 | 20.00 | 0.50 | 20.70 | 20.20 | 0.1059 |
| 2 | 20.00 | 6.00 | 26.00 | 20.00 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | 两途径最终达到平衡时,体系内混合气体的百分组成不同 | |
| C. | 途径Ⅰ到达平衡所用时间一定等于途径Ⅱ到达平衡所用时间 | |
| D. | 达平衡时,途径Ⅰ所得混合气体的密度等于途径Ⅱ所得混合气密度的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的PH=4 | |
| B. | 升高温度,溶液的PH增大 | |
| C. | 稀释时溶液中所有离子的浓度都减少 | |
| D. | 此酸的电离平衡常数约为1×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com