
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造.以镍粉废料为原料制备Ni2O3的工艺如图1 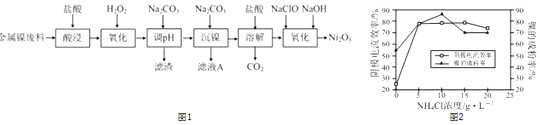
回答下列问题:
(1)Ni2O3中Ni的化合价为 .
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是 .
(3)加入H2O2“氧化”的离子方程式为;滤渣A的主要成分是(填化学式).
(4)工艺中分步加入Na2CO3的作用是;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为 .
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉.当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图2所示: ①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因: .
【答案】
(1)+3
(2)温度高,HCl挥发加快
(3)2Fe2++2H++H2O2=2Fe3++2H2O;Fe(OH)3
(4)将Fe3+和Ni2+分别沉淀出来;1:4
(5)0.2;随着NH4+浓度增大,水解平衡NH4++H2?NH3?H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2
【解析】解:(1)Ni2O3中氧元素﹣2价,化合物中化合价代数和为0,则Ni的化合价为+3;所以答案是:+3;(2)温度过高,HCl挥发,不利用金属离子的溶解;所以答案是:温度高,HCl挥发加快;(3)过氧化氢氧化亚铁离子为铁离子,发生的反应为:2Fe2++2H++H2O2=2Fe3++2H2O;加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀,则滤渣为Fe(OH)3;所以答案是:2Fe2++2H++H2O2=2Fe3++2H2O;Fe(OH)3;(4)工艺中分步加入Na2CO3的作用是将Fe3+和Ni2+分别沉淀出来,为提高原料的利用率,NaClO与NaOH“氧化”生成Ni2O3的离子方程式为2Ni2++ClO﹣+4OH﹣=Ni2O3↓+Cl﹣+2H2O,加入NaClO与NaOH的物质的量之比为 1:4; 所以答案是:将Fe3+和Ni2+分别沉淀出来;1:4;(5)①根据图2可知,NH4Cl的浓度为10gL﹣1时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10 gL﹣1 , 浓度为 ![]() mol/L≈0.2mol/L;所以答案是:0.2;②当NH4Cl溶液的浓度大于15g/L时,随着NH4+浓度增大,水解平衡NH4++H2NH3H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2;所以答案是:随着NH4+浓度增大,水解平衡NH4++H2NH3H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2 .
mol/L≈0.2mol/L;所以答案是:0.2;②当NH4Cl溶液的浓度大于15g/L时,随着NH4+浓度增大,水解平衡NH4++H2NH3H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2;所以答案是:随着NH4+浓度增大,水解平衡NH4++H2NH3H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2 .


科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质。下列判断正确的是
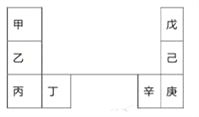
A. 金属性:甲>乙>丁 B. 原子半径:辛>己>戊
C. 丙和庚的原子核外电子数相差11 D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.0 g铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A. 3.50 mol·L-1
B. 1.75 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮通常是无色液体,不溶于水,且密度小于水,沸点约是55℃.要从丙酮和水的混合物中将丙酮分离出来,下列操作中最合理的是 ( )
A.蒸馏
B.分液
C.过滤
D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.
(1)基态铜原子的电子排布式为;价电子中成对电子数有个.
(2)磷化铜与水作用产生有毒的磷化氢(PH3). ①PH3分子中的中心原子的杂化方式是 .
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由: .
(3)磷青铜中的锡、磷两元素电负性的大小为SnP(填“>”“<”或“=”).
(4)某磷青铜晶胞结构如图所示. 
①则其化学式为 .
②该晶体中距离Cu原子最近的Sn原子有个,这些Sn原子所呈现的构型为 .
③若晶体密度为8.82g/cm3 , 最近的Cu原子核间距为pm(用含NA的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油墨是由多种色素按一定比例混合而成,某同学欲用纸上层析的方法将其主要色素分离开来,可选用作展开剂的物质是( )
A.盐酸
B.酒精
C.NaOH溶液
D.丙酮+盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:168O2、188O2、H、126C、![]() Na、
Na、![]() 7N、146C、
7N、146C、![]() Mg。
Mg。
(1)表示核素的符号共________种。
(2)互为同位素的是______________。
(3)质量相同的H![]() O和D
O和D![]() O所含中子数之比为________。
O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2 [Be(OH) 4]的离子方程式__________________。
(5)Be(OH) 2与Mg(OH)2可用_______________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓盐酸和浓硝酸均应保存在棕色试剂瓶中
B. 稀释浓硫酸时一定将水沿器壁缓缓注入浓硫酸中并不断搅拌
C. 滴瓶中的滴管用后不用清洗,直接放到滴瓶中
D. 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com