
NA表示阿伏加德罗常数的值。下列说法中正确的有几项:
①lmolCl2做氧化剂时得到的电子效为2NA
②25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA
③过氧化钠与水反应时,生成0.5molO2转移的电子数为2NA
④50mL18.4mol/L的浓硫酸与足量的铜微热后反应,生成SO2分子数小于0.46NA
⑤利用氰尿酸与次氯酸在一定pH下反应可制备三氯异氰尿酸(结构如图)。若原料完全反应,得到1mol产物同时生成3NA个H2O
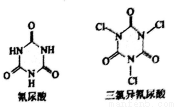
A. 0 B. 1 C. 2 D. 3
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:填空题
有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只由离子键构成的物质是________
(2)只由极性键构成的物质是________
(3)只由非极性键构成的物质是____
(4)只由非金属元素组成的离子化合物是__ __
(5)由极性键和非极性键构成的物质是____ _
(6)由离子键和极性键构成的物质是___ 、 _
(7)由离子键和非极性键构成的物质是_ _ _
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是( )
A. 向 H2O中通人 NO2:3NO2+H2O=H++NO3-+2NO
B. 向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O=H2SiO3↓+2Na++SO32-
C. 用饱和纯碱溶液洗涤试管中残留的苯酚:CO32-+2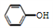
 2
2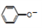 +CO2↑+H2O
+CO2↑+H2O
D. 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-= 3BaSO4↓+2Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
丁列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示
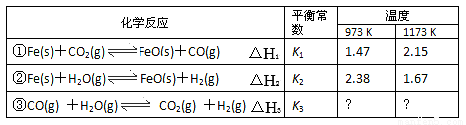
下列说法正确的悬
A. △H1<0,△H2>0
B. 反应①②③的反应热满足关系:△H2-△H1=△H3
C. 反应①②③的平衡常数满足关系;K1·K2=K3
D. 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
已知25℃时某溶液中含有大量Na+、H+、Fe3+、HC03-、OH-、I-中的几种,并且水 电离出的c(H+)=1×lO-13 mol/L.当向该溶液中缓慢通入一定量的Cl2后,溶液由无色 变为黄色.下列有关分析正确的是
A. 溶液的pH=1或13 B. 溶液中一定没有Fe3+,Na+
C. 溶液中阴离子有I-,不能确定HCO3- D. 当Cl2过量,所得溶液只含有两种盐
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:简答题
甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.0 kJ• mol-1
CH3OH(g) △H1=-90.0 kJ• mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
回答下列问题:
(1)若由合成气(CO、H2)制备lmolCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=________kJ • mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)有人模拟该制备原理,500K时,在2L的密闭容器中充入2molCO和6mol H2,5min达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反应①的速率是_______mol·L-1·min-1,可逆反应②的平衡常数K2=_________。
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正_______v逆(填“>”、“< ”或“=”)。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是_______。
A.在平衡移动过程中逆反应速率先增大后减小
B.容器中CH3OCH3的体积分数增大
C.容器中混合气体的平均相对分子质量减小
D.达到新平衡后体系的压强增大
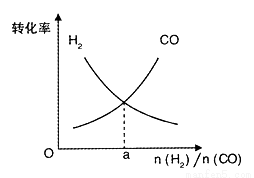
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a =_________(填数值)。
(5)绿色电源“二甲醚燃料电池”的结构图所示,电解质为熔融态的碳酸盐(如熔融 K2CO3),其中CO2会参与电极反应。工作时负极的电极反应为____________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做__________。

查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是( )
A. 2-甲基丁烷也称异丁烷 B. 乙烯、苯都能发生加成反应
C. 乙烯、聚氯乙烯分子中都含有碳碳双键 D. 淀粉、油脂、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
以下各组中的两物质在发生相应变化时所克服的微粒间的作用力完全相同的是(  )
)
A. 蔗糖溶于水和硫酸溶于水 B. 二氧化硅熔化和冰熔化
C. 干冰升华和液溴挥发 D. 食盐粉碎 和冰粉碎
和冰粉碎
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:实验题
甲苯氧化法制备苯甲酸的反应原理如下:
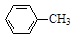 + 2KMnO4
+ 2KMnO4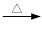
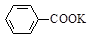 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
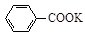 + HCl
+ HCl
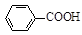 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。

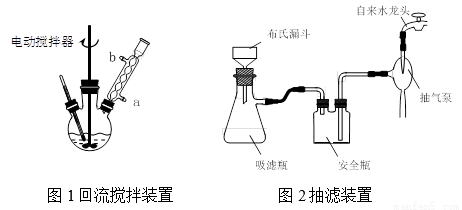
⑴实验室中实现操作Ⅰ所需的玻璃仪器有_____、烧杯;操作Ⅱ的名称为_____。
⑵如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是_______________。
⑶在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是__________;如图2所示抽滤完毕,应先断开_____之间的橡皮管。
⑷纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com