
| A. | a-b-c-d-e-e-f-g-h | B. | a-e-d-c-b-h-j-g | ||
| C. | a-d-e-c-b-h-j-g | D. | a-c-b-d-e-h-j-f |
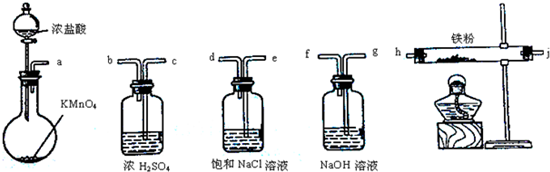
分析 实验室制备无水氯化铁,需要先制取纯净、干燥的氯气,用a装置制备氯气,制取出的氯气中有HCl和水蒸气,应先用饱和食盐水洗气除去HCl,选用ed,由于无水氯化铁遇潮湿空气极易吸水生成FeCl3•nH2O,cb用于干燥氯气,制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,氯气是污染性气体,连接尾气处理装置吸收未反应的氯气,防止污染空气,根据实验原理和目的及各装置的作用决定仪器排列组装顺序.
解答 解:实验室制备无水氯化铁,需要先制取纯净、干燥的氯气,用a装置制备氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故最先使用的仪器是a;
浓盐酸有挥发性,所以氯气中含有氯化氢气体,制取出的氯气中有HCl和水蒸气,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体,而洗气时,气体要长进短出,故接下来的气流的方向是e→d;
然后用浓硫酸干燥氯气,故接下来的气流的方向是c→b;
制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,故接下来连h;
氯气是污染性气体,对空气有污染,故应连接尾气处理装置,考虑到氯气是酸性气体,故要用碱液来吸收,故接下来通入NaOH 溶液,气流的方向是j→g;
故仪器连接顺序正确的是a-e-d-c-b-h-j-g,
故选B.
点评 本题考查了制备实验方案设计评价,侧重考查仪器的连接顺序的问题,重点是掌握气体的除杂的方法和顺序以及制备无水FeCl3原理,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:多选题
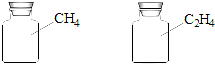
| A. | 所含原子数相等 | B. | 所含氢原子数相等 | ||
| C. | 所含分子数相等 | D. | 气体密度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:
某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:
醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1-丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com