
| A.向0.1mol/L的CH3COOH中加入少量CH3COONa固体,溶液pH增大 |
| B.新制氯水放置一段时间后颜色消失 |
| C.在密闭容器中充入一定量NO2建立2NO2(g)?N2O4(g)平衡后,增大压强,体系颜色加深 |
| D.在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去 |


科目:高中化学 来源:不详 题型:单选题
| A.t1时刻,υ(正)>υ(逆) | B.t2时刻,υ(正)>υ(逆) |
| C.t3时刻,υ(正)<υ(逆) | D.t4时刻,υ(正)=υ(逆) |
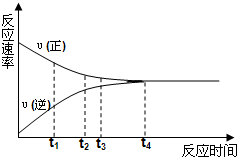
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两容器中达到平衡的时间A<B |
| B.A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C.打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D.打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |
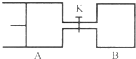
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Z和W在该条件下至少有一个是为气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 |
| D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
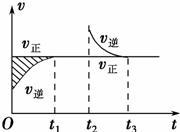
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.改变反应条件不能改变化学反应的限度 |
| B.延长化学反应的时间能改变化学反应的限度 |
| C.可逆反应达到化学平衡状态时,正反应速率和逆反应速率相等 |
| D.化学平衡状态是一种静止状态,反应物和生成物的浓度不再改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.平衡混合所中G的质量分数 |
| B.平衡混合所中R的质量分数 |
| C.G的转化率 |
| D.L转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
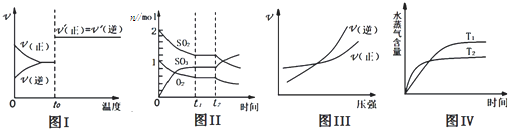 ( )
( )| A.图I:反应H2+I2?2HI达平衡后,升高温度时反应速率随时间的变化 |
| B.图Ⅱ:反应2SO2+O2?2SO3达平衡后,缩小容器体积时各成分的物质的量变化 |
| C.图III:反应N2+3H2?2NH3在温度一定的情况下,反应速率与压强的关系 |
| D.图IV:反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
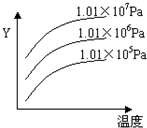
 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题: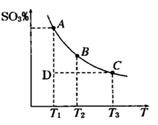
 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),| A.体系的密度不发生变化 | B.SO2与SO3的体积比保持不变 |
| C.体系中硫元素的质量百分含量不再变化 | D.单位时间内转移4 mol 电子,同时消耗2 mol SO3 |
 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。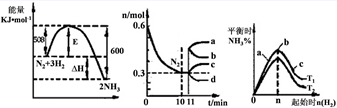
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com