
| A. | 熔融的NaCl | B. | KNO3溶液 | C. | Cu | D. | 酒精 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质;能导电的物质中含有自由电子或自由移动的阴阳离子;单质、混合物不是电解质,据此即可解答.
解答 解:A.熔融的NaCl,是化合物,能电离出自由移动的钠离子和氯离子,能导电,属于电解质,故A正确;
B.KNO3溶液中有自由移动的钾离子和硝酸根离子,能导电,但KNO3溶液是混合物,不是电解质,故B错误;
C.铜是金属能导电,但它是单质,不是电解质,故C错误;
D.酒精是乙醇,是化合物,在水中存在乙醇分子,没有自由移动的离子,故不能导电,是非电解质,故D错误;
故选A.
点评 本题重点考查了电解质概念的辨析,解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件,混合物不是电解质进行解题,题目难度不大.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能产生丁达尔效应 | |
| B. | 有相同的颜色 | |
| C. | 分散质颗粒直径都在1-100nm之间 | |
| D. | 加入浓氢氧化钠溶液都产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
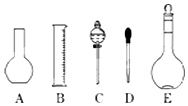 实验室需要0.1mol/L NaOH溶液500mL.根据这种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液500mL.根据这种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
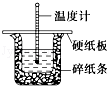 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com