
下列描述或化学用语书写错误的是()
A. 向Fe(0H)3胶体中滴加稀硫酸,先生成红褐色沉淀,后沉淀逐渐溶解
B. 向铜粉中加入稀硫酸,铜粉不溶解,再加入硝酸钾固体,铜粉逐渐溶解
C. 氯碱工业和金属钠的冶炼都用到了NaCl,阳极上发生的电极反应都是:2Cl﹣2e﹣═Cl2↑
D. 向明矾(KAl(SO4)2•12H2O)溶液中滴入Ba(OH)2溶液,SO42﹣恰好完全沉淀时的离子方程式为:Ba2++3OH﹣+Al3++SO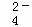 ═BaSO4↓+Al(OH)3↓
═BaSO4↓+Al(OH)3↓
考点: 胶体的重要性质;离子方程式的书写;电解原理;硝酸的化学性质.
专题: 基本概念与基本理论;元素及其化合物.
分析: A.胶体具有均一稳定性,加入电解质会使胶体发生聚沉,氢氧化铁胶体逐滴加入溶液,先产生沉淀后沉淀溶解,说明先胶体聚沉,后能溶解沉淀;
B.依据金属活动顺序表分析,铜和稀硫酸不反应,加入硝酸铜溶液中稀硝酸具有强氧化性能氧化铜,铜粉溶解;
C.氯碱工业阳极反应为2C1﹣﹣2e﹣=C12↑,金属钠的冶炼阳极反应为2C1﹣﹣2e﹣=C12↑;
D.反应生成偏铝酸根.
解答: 解:A.加入稀硫酸是电解质溶液,会引起氢氧化铁胶体聚沉,继续加入稀硫酸,氢氧化铁沉淀会溶解,故A正确;
B.铜和稀硫酸不反应,加入硝酸铜溶液中稀硝酸具有强氧化性能氧化铜,铜粉溶解,故B正确;
C.氯碱工业阳极反应为2C1﹣﹣2e﹣=C12↑,金属钠的冶炼阳极反应为2C1﹣﹣2e﹣=C12↑,阳极反应都是:2C1﹣﹣2e﹣=C12↑,故C正确;
D.反应生成偏铝酸根:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O,故D错误.
故选D.
点评: 本题考查离子方程式的书写,题目难度中等,本题中注意把握物质的性质以及反应的过量问题,为易错点.


科目:高中化学 来源: 题型:
用食用白醋(醋酸浓度约1mol/L)常温下进行下列实验,能证明醋酸为弱电解质的是( )
|
| A. | 白醋中滴入石蕊试液呈红色 |
|
| B. | 实验测得该白醋的pH为2.3 |
|
| C. | 蛋壳浸泡在白醋中有气体放出 |
|
| D. | 白醋加入豆浆中有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硝化反应说法正确的是( )
|
| A. | 硝化反应属于取代反应 |
|
| B. | 硝化反应中混合酸的配制是先加浓硫酸再加浓硝酸 |
|
| C. | 甲苯硝化反应的产物只有一种 |
|
| D. | 硝基苯的密度小于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为 ;
(2)反应是 反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(CH2)=c(CO)•c(H2O),试判断此时的温度为 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合液中含有等物质的量的CuSO4、FeSO4、Fe2(SO4)3.已知如表数据,下列叙述正确的是()
物质(25℃) Cu(OH)2 Fe(OH)2 Fe(OH)3
Ksp 2.2×10﹣20 8.0×10﹣16 4.0×10﹣38
完全沉淀时的pH ≥6.4 ≥9.6 ≥3~4
A. 混合溶液中:c(SO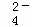 ):=5:4
):=5:4
B. 若向混合溶液中加入铁粉,不可能观察到红色固体析出
C. 若向混合溶液中加入足量氯水,调节pH到3﹣4后过滤,得到纯净的CuSO4溶液
D. 若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(0H)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门以实验为基础的科学.
(1)下列叙述中正确的是 (填序号).
A.分液漏斗、滴定管和容量瓶使用前必须检查是否漏水
B.将碘水倒入分液漏斗,再加适量乙醇,充分振荡、静置,可从碘水中萃取碘
C.洁净的铁钉在食盐水中浸泡一段时 间,铁钉上有气泡,说明铁发生了析氢腐蚀
间,铁钉上有气泡,说明铁发生了析氢腐蚀
D.铁丝在氯气中剧烈燃烧,火星四射,生成黑色固体
E.酸碱中和滴定实验中,锥形瓶用蒸馏水洗净后直接使用,而滴定管用蒸馏水洗净后,必须润洗后使用
(2)用铜片与稀硝酸反应制取NO气体,如图装置中适合的是 (填序号);装置B中的试剂最好是 ,该装置的作用是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种醇同足量的金属钠完全反应,在相同的条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,则A、B、C三种醇分子里羟基数之比为()
A. 3:2:1 B. 2:6:3 C. 3:1:2 D. 2:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Al-Fe合金的叙述不正确的是 ( )。
A.Al-Fe合金具有很高的熔点,能用于制造火箭外层材料
B.Al-Fe合金能溶解在硝酸中
C.Al-Fe合金可以用于制造汽车板材
D.Al-Fe合金的密度低于铁的密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com