
| A. | C2A | B. | C2B | C. | D2A | D. | D2B |
分析 A、B两元素的原子分别获得两个电子形成稳定结构时,A放出的能量大于B放出的能量.说明A得电子的能量强于B,非金属性比B强;
C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量.说明C失电子的能力比D高,金属性比D高,以此解答该题
解答 解:得电子形成稳定结构放出的能量越多,说明元素原子越易得电子,元素的非金属性越强,同理,失电子形成稳定结构吸收的能量越多,说明元素原子越难失电子,元素的金属性越弱,
A、B两元素的原子分别获得两个电子形成稳定结构时,A放出的能量大于B放出的能量.说明A得电子的能量强于B,非金属性比B强;
C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量.说明C失电子的能力比D高,金属性比D高,
因此,A、C之间最易形成离子化合物.
故选A.
点评 本题考查原子的结构与元素周期律的关系,为高频考点,题目难度不大,注意原子得失电子与能量的大小关系和非金属性、金属性强弱的联系.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-+4H+ | |
| C. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、NO3- | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊变红色溶液:Ca2+、K+、HCO3-、Cl- | |
| B. | 强碱性的无色溶液:Na+、Ba2+、OH-、Cl- | |
| C. | PH=7的无色溶液:NH4+、Mg2+、MnO4-、HCO3- | |
| D. | 加锌能产生氢气的溶液:H+、Cu2+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易升华 | B. | 蒸气呈紫色 | C. | 易溶于油脂 | D. | 与淀粉显蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向HCl和AlCl3的混合液中滴加NaOH溶液 | |
| B. |  向NaOH和Ca(OH)2的混合液中通入CO2 | |
| C. |  向NH4Al(SO4)2溶液中滴加 Ba(OH)2溶液 | |
| D. |  向NaOH和Na2CO3的混合液中滴加稀HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu2S既是氧化产物又是还原产物 | |
| B. | 发生反应,有10mol电子转移 | |
| C. | 产物中的SO42-有一部分是氧化产物 | |
| D. | FeS2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 微粒浓度关系:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
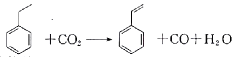
| A. | 分子中含有4个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com