
【题目】室温下向10mL 0.1molL﹣1 NaOH溶液中逐滴加入0.1molL﹣1的一元酸HA,溶液pH的变化曲线如图所示. 
(1)酸碱中和滴定时,用到的仪器有酸式滴定管、碱式滴定管、铁架台(带蝴蝶夹)、 .
(2)a点(横坐标为10)所示溶液中,溶质是 , 溶液中c(Na+)、c(A)、c(H+)、c(OH﹣)从大到小的顺序为 , 其中c(Na+)c(A﹣)+c(HA)(填“>”“<”或“=”)
(3)c点所示溶液中,c(Na+)c(A﹣)(填“>”“<”或“=”)
(4)b点所示溶液中,c(A﹣)c(HA)(填“>”“<”或“=”)
(5)a、b、c点所示溶液中,水的电离程度最大的是 .
(6)以下滴定操作会导致V(HA)偏大的是 . A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、最后一滴HA溶液附在锥形瓶内壁上未冲下
E、滴定开始前读数时平视,滴定终点,读数时俯视.
【答案】
(1)锥形瓶
(2)NaA;c(Na+)>c(A﹣)>c(OH﹣)>c(H+);=
(3)=
(4)>
(5)a
(6)A、D
【解析】解:(1)中和滴定需要用到铁架台(带蝴蝶夹)、酸式滴定管、碱式滴定管、锥形瓶;所以答案是:锥形瓶;(2)a点时酸碱恰好中和,溶质为NaA,NaA水解呈碱性,A﹣的水解程度减小,溶液中c(Na+)>c(A)>c(OH﹣)>c(H+);a点所示溶液中溶质为NaA,根据物料守恒可得:c(Na+)=c(A﹣)+c(HA);
所以答案是:NaA;c(Na+)>c(A﹣)>c(OH﹣)>c(H+);=;(3)c点所示溶液呈中性,则c(OH﹣)=c(H+),由电荷守恒得:c(Na+)+c(H+)=c(A﹣)+c(OH﹣);
所以c(Na+)=c(A﹣);
所以答案是:=;(4)b点溶质为等浓度的NaA和HA,HA的电离程度大于NaA的水解程度,c(A﹣)>c(HA);
所以答案是:>;(5)根据图像知,该酸是弱酸,a、b、c点的溶质分别是盐、盐和酸、盐和酸,a点盐类水解促进水电离,b点盐类水解小于酸的电离,水的电离程度受到抑制,c点溶液呈中性,水的电离程度不受影响,所以a、b、c三点溶液中水的电离程度最大的是a;
所以答案是:a;(6)A、滴定管滴定前有气泡,滴定后气泡消失,导致V(HA)偏大,故A正确;
B、锥形瓶洗涤后没有干燥,NaOH的物质的量不变,导致V(HA)不变,故B错误;
C、滴定时锥形瓶中有液体溅出,NaOH的物质的量偏小,导致V(HA)偏小,故C错误;
D、最后一滴HA溶液附在锥形瓶内壁上未冲下,导致V(HA)偏大,故D正确;
E、滴定开始前读数时平视,滴定终点,读数时俯视,导致V(HA)偏小,故E错误;
故选AD.
【考点精析】关于本题考查的酸碱中和滴定,需要了解中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能得出正确答案.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是( )
A.密度比为16∶11B.密度比为11∶16
C.体积比为16∶11D.原子数比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/gcm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
请回答下列问题: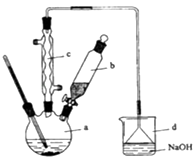
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 , 要进一步提纯,下列操作中必须的是(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.工业上,向500﹣600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁.某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如图探究实验,请回答下列问题: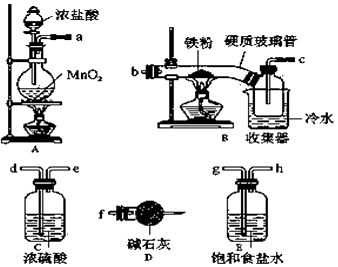
(1)装置的连接顺序为a→ , → , →b,c→ .
(2)i.A中反应的离子方程式: .
ii.D中碱石灰的作用是 .
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端.要使沉积的FeCl3进入收集器,需进行的操作是 .
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验: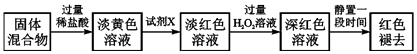
①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为 .
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是(用离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.SO2的摩尔质量是64g
B.18g H2O在标准状况下的体积是22.4L
C.在标准状况下,20mL NH3 与60mL O2所含的分子数比为1:3
D.将40g NaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中含有的少量K2SO4杂质得到纯的KCl,选用的最佳试剂及顺序为( )
①BaCl2 ②Ba(NO3)2 ③K2CO3 ④Na2CO3 ⑤HCl ⑥HNO3
A.①②B.①③⑤C.②③⑥D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠溶液含有少量的氯化铁。若要得到纯净的固体氯化钠,可供选择的操作有:①加适量盐酸溶液、②加金属铁粉、③蒸发结晶、④加过量氢氧化钠溶液、⑤冷却热饱和溶液、⑥过滤。正确的操作步骤是( )
A. ②⑥③B. ④⑥①③C. ④⑥③⑤D. ②⑥①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是
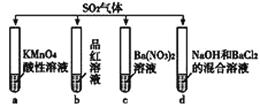
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,该沉淀的成分为BaSO3
D. 试管d中能产生白色沉淀,该沉淀完全溶于稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com