
 CH3COOC2H5+H2O
CH3COOC2H5+H2O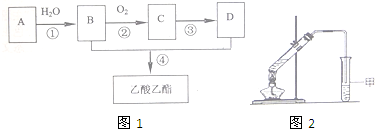
分析 有机物A的产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯;乙烯和水反应生成乙醇,则B是乙醇;乙醇被氧气氧化生成C、C反应生成D,D和乙醇反应生成乙酸乙酯,则D是乙酸、C是乙醛,据此进行解答.
解答 解:有机物A的产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯,乙烯和水反应生成乙醇,则B是乙醇,乙醇被氧气氧化生成C,C反应生成D,D和乙醇反应生成乙酸乙酯,则D是乙酸,C是乙醛,
(1)A乙烯,则A中的官能团是碳碳双键,乙烯和水发生加成反应生成乙醇,所以反应类型是加成,
故答案为:碳碳双键;加成;
(2)反应②为:在铜作催化剂、加热条件下,乙醇被氧气氧化生成乙醛和水,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
反应④为:在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;CH3COOH+C2H5OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(3)G是乙酸乙酯的同分异构体,且G能与NaHCO3反应,则G中含有羧基,为丁酸,可能的结构简式为:CH3CH2CH2COOH、(CH3)2CHCOOH,
故答案为:CH3CH2CH2COOH、(CH3)2CHCOOH;
(4)①生成物含有乙醇和乙酸,二者都易溶于水,不能用插入到液面以下,否则产生倒吸现象,故答案为:防止倒吸;
②生成的乙酸乙酯不溶于饱和碳酸钠溶液,应用分液的方法分离,故答案为:b;
③由于乙酸的沸点较低,则乙酸易挥发,挥发出来的乙酸可与碳酸钠发生反应:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑,所以产生气泡,
故答案为:乙酸的沸点低,加热时,少量乙酸进入试管甲,振荡时,乙酸与碳酸钠接触,发生反应2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑,产生气泡.
点评 本题考查有机物的推断,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握乙酸乙酯的制取原理及操作方法,试题侧重于学生分析能力、实验能力的考查,


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室用KClO3制取氧气所剩余的KCl和MnO2的混合物 | |
| B. | 实验室用稀盐酸和大理石反应制取CO2时,得到的CaCl2和大理石的混合物 | |
| C. | 某同学用氢气还原氧化铜来制取纯净的铜,由于最后操作不当而使还原生成的铜部分被氧化后剩余的混合物 | |
| D. | 用过量的Zn粉和稀H2SO4溶液来制取H2最后剩余的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等温浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 在0.1mol•L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 等温浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量的6 mol•L-1的盐酸 | B. | 加入适量蒸馏水 | ||
| C. | 加热 | D. | 用锌粉替代锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
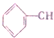
| A. | 二者互为同系物 | B. | 均易溶于水 | ||
| C. | 均能与金属钠反应生成氢气 | D. | 可用紫色石蕊溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 状态Ⅱ和状态ⅢCO2的转化率相同 | |
| B. | 体系的总压强PⅢ:P总(状态Ⅱ)>2PⅠ (状态Ⅰ) | |
| C. | 反应的平衡常数:KⅠ>KⅡ=KⅢ | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =CH2 D.
=CH2 D.
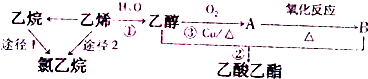
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 原子半径:Na<Mg<Al | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com