
锌与很稀的硝酸溶液反应的化学方程式为:
4Zn +10HNO3== 4Zn(NO3)2 + NH4NO3 + 3H2O,按要求回答下列问题:(共10分)
(1)该反应中HNO3表现的化学性质是 。(填序号)
① 只有酸性 ② 只有氧化性 ③ 只有还原性 ④酸性与还原性 ⑤ 酸性与氧化性
(2)现有13.0 g 锌与足量的稀硝酸发生上述反应,则反应过程中转移的电子物质的量是多少?被还原的HNO3物质的量是多少?(写出规范的计算过程)
科目:高中化学 来源: 题型:
由乙炔为原料制取CHClBr—CH2Br,下列方法中最可行的是( )
A.先与HBr加成后再与HCl加成 B.先与H2完全加成后再与Cl2、Br2取代
C.先与HCl加成后再与Br2加成 D.先与Cl2加成后再与HBr加成
查看答案和解析>>
科目:高中化学 来源: 题型:
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。
已知:①过碳酸钠具有Na2CO3和H2O2的性质。
②2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
③50 °C时 2Na2CO3·3H2O2 (s) 开始分解
某兴趣小组制备过碳酸钠的装置示意图如下:
 |
请回答下列问题:
(1)图中玻璃导管a的作用是
(2)本实验的关键是控制温度,用该装置制备过碳酸钠有不足之处,下列改进措施可行的是 (填序号)。
A、缓慢滴加H2O2溶液 B、冷水浴 C、用酒精灯加热
(3)将实验改进后按以下流程可获得过碳酸钠产品

①洗涤固体Y时选用无水乙醇作为洗涤剂的目的是
②在滤液X中加入适量中加入适量NaCl固体可析出过碳酸钠,原因是
(4)下列物质中,会引起过碳酸钠失效的有 。
A.Na2S B.FeCl3 C.Na2SiO3 D.NaHCO3
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取m1g样品→溶解→沉淀反应→ 过滤过滤
→ 洗涤洗涤
→ 干燥干燥
→ 称量m2g。
①写出沉淀反应的离子方程式______________________________________
②产品中过碳酸钠质量分数的表达式为: 。
③结果与分析:
查看答案和解析>>
科目:高中化学 来源: 题型:
现有4种元素A、B、C、D。已知A-离子核外有18个电子;B原子最外层电子数与D原子核外电子数相同,且B原子比D原子多两个电子层;D+离子核外没有电子;C元素原子核外电子比B元素原子核外电子多5个。(共15分)
(1)写出这四种元素的符号:
A : B : C : D :
(2)画出B、C原子和A-离子的结构示意图:
; ; 。
(3)分析元素A、元素B在元素周期表中的位置:A元素位于第 周期、 族;B元素位于第 周期、第 族
(4)分别写出D元素与A元素组成的化合物及B元素与C元素形成的化合物的电子式:
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol甲基中含电子数目为7NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.14g乙烯和丁烯的混合物中含有的原子总数为3NA个
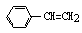 |
D.1mol苯乙烯( )中含有的C=C数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知烯烃、炔烃在臭氧的作用下发生以下反应:
CH3—CH===CH—CH2—CH===CH2→CH3CHO+OHC—CH2—CHO+HCHO
CH3—C≡C—CH2—C≡CH―→CH3COOH+HOOCCH2COOH+HCOOH 某烃分子式为C10H10,在臭氧作用下发生反应:C10H10→CH3COOH+3HOOC—CHO+CH3CHO,下列判断正确在是:( )
A.其结构中含有4个碳碳双键,4个碳碳三键
B.分子中含有4个碳碳双键和2个碳碳三键
C.该烃结构简式是:CH3-C≡C-CH=CH-C≡C-CH=CH-CH3
D. 其结构中含有2个碳碳双键,4个碳碳三键
查看答案和解析>>
科目:高中化学 来源: 题型:
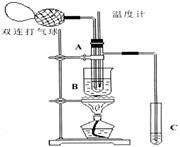
乙醛在氧化铜催化剂存在的条件下,可被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)写出一种检验乙醛中含有醛基的方法(用方程式表示,任意写出一种):
(3)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是_____________________________;
(4)烧杯B的作用是___________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(5)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.增大反应物浓度,可增大单位体积内活化分子的数目,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂影响反应活化能,能增大单位体积内活化分子的百分比,从而增大反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com