
| A. | 将碘晶体中含有的少量沙子除去采用蒸馏的方法 | |
| B. | 蒸馏操作使用的温度计的水银球应插入到液体内 | |
| C. | 分离液体时,分液漏斗上的小孔与大气相通时打开活塞 | |
| D. | 若分液时不小心有少量上层液体流下来,补救措施是用滴管将其从烧杯中吸出 |
分析 A.碘易升华;
B.蒸馏是用来分离沸点不同的液体混合物;
C.使分液漏斗上的小孔与大气相通,才能使内外压强一致;
D.应静置后重新分液.
解答 解:A.碘易升华,则将碘晶体中含有的少量沙子除去采用加热的方法,故A错误;
B.蒸馏是用来分离沸点不同的液体混合物,温度计测量的是蒸汽的温度,故应放在支管口,故B错误;
C.使分液漏斗上的小孔与大气相通,才能使内外压强一致,保证液体顺利流出,故C正确;
D.不小心有少量上层液体流下来,应静置后重新分液,故D错误.
故选C.
点评 本题考查物质的分离、提纯和除杂的基本操作,题目难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.


科目:高中化学 来源: 题型:填空题
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| 1 | 0.2 | 0.2 | >7 |
| 2 | a | 0.4 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
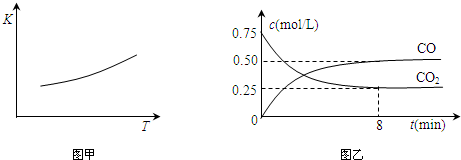
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| D. | 硫酸与Cu(OH)2反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
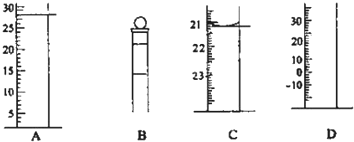
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇既可以发生催化氧化反应,又可以发生酯化反应 | |
| B. | 用溴水可以鉴别乙醇、乙酸和苯 | |
| C. | 糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素 | |
| D. | C5H10O属于醛类的同分异构体为六种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com