
【题目】氢氧燃料电池构造如图所示。其电池反应方程式为: 2H2+O2=2H2O,下列说法不正确的是
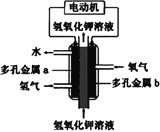
A. 多孔金属a作负极
B. 多孔金属b上,发生还原反应
C. 电池工作时,电解质溶液中OH移向a极
D. 正极的电极反应为:O2+4e+4H+=2H2O
【答案】D
【解析】
氢氧碱性燃料电池中,通入氢气的一极为电源的负极a,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为原电池的正极,b电极反应式为O2+4e-+2H2O=4OH-,原电池工作时,电子由负极a经外电路流向正极b,内电路中阳离子移向正极b、阴离子移向负极a,据此解答。
A.氢氧碱性燃料电池中,通入氢气的一极失去电子、发生氧化反应,为电源的负极,即多孔金属a作负极,故A正确;
B.通入氧气的一极为原电池的正极,O2在正极b上得到电子、被还原,故B正确;
C.原电池工作时,内电路中阳离子移向正极b、阴离子移向负极a,即电解质溶液中OH-移向a极,故C正确;
D.碱性条件下,在电极方程式的书写中不会出现H+,正极b电极反应式为O2+4e-+2H2O=4OH-,故D错误;答案为D。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A. 标准状况下,22.4LH2O含有的分子数为1 NA
B. 常温常压下,16g O2含有的原子数为1 NA
C. 通常状况下,1NA 个SO2分子占有的体积约为22.4L
D. 物质的量浓度为0.5mol/L的K2SO4溶液中,含有SO42-个数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
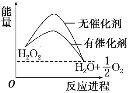
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是

A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)写出二氧化碳的电子式________________。
(2)写出有机物CH3CH2CH2CH(CH3)2的名称__________________。
(3)铁片、铜片连接后浸入稀硫酸形成原电池,正极反应式是_________________。
(4)乙醇的热值为Q kJ·g-1,写出乙醇完全燃烧生成CO2气体和液态水的热化学方程式______________。
(5)写出苯与浓硫酸、浓硝酸在55℃下反应的化学方程式____________________。
(6)烃X分子中碳与氢的质量比为36∶7,化学性质与甲烷相似,则烃X的同分异构体共有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同主族非金属元素的简单阴离子的还原性越强,其元素非金属性越强
B. ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
C. 元素原子的最外层电子数等于元素的最高化合价
D. 全部由非金属元素组成的化合物中只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.金属只有正价,非金属只有负价
B.氟无正价,氧无最高正价
C.主族元素的最高正价等于其原子最外层电子数
D.同周期元素的最外层电子数越多,原子半径越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com