
【题目】以下自发反应能用ΔH判据来解释的是( )
A. 硝酸铵自发地溶于水
B. 2N2O5(g)===4NO2(g)+O2(g) ΔH=+156.7 kJ·mol-1
C. (NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
【答案】D
【解析】硝酸铵的溶解过程是吸热过程,反应能够自发进行是因为其熵值增加,主要是熵判据,故A错误;2N2O5(g)![]() 4NO2(g)+O2(g) △H="+56.7" kJ/mol,反应焓变大于0,为吸热反应,该反应的熵值增加,反应能够自发进行是因为其熵值增加,主要是熵判据,故B错误;(NH4)2CO3(s)
4NO2(g)+O2(g) △H="+56.7" kJ/mol,反应焓变大于0,为吸热反应,该反应的熵值增加,反应能够自发进行是因为其熵值增加,主要是熵判据,故B错误;(NH4)2CO3(s)![]() NH4HCO3(s)+NH3(g) △H="+74.9" kJ/mol,反应为吸热反应,该反应的熵值增加,反应能够自发进行是因为其熵值增加,主要是熵判据,故C错误;2H2(g)+O2(g)
NH4HCO3(s)+NH3(g) △H="+74.9" kJ/mol,反应为吸热反应,该反应的熵值增加,反应能够自发进行是因为其熵值增加,主要是熵判据,故C错误;2H2(g)+O2(g)![]() 2H2O(l) △H="-285.8" kJ/mol,该反应熵值减小,反应为放热反应,反应能够自发进行是因为其焓变<0,主要是焓判据,故D正确。
2H2O(l) △H="-285.8" kJ/mol,该反应熵值减小,反应为放热反应,反应能够自发进行是因为其焓变<0,主要是焓判据,故D正确。


科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( ) 实验后的记录:
①Zn为正极,Cu为负极
②Cu极上有气泡产生,发生还原反应
③SO42﹣向Zn极移动
④若有0.5mol电子流经导线,则产生5.6L气体
⑤电流的流向是:Cu→Zn
⑥负极反应式:Cu﹣2e﹣═Cu2+ , 发生氧化反应.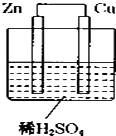
A.②④⑤
B.②③⑤
C.①④⑥
D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列实验各装置图的叙述,不正确的是( ) 
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④中可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
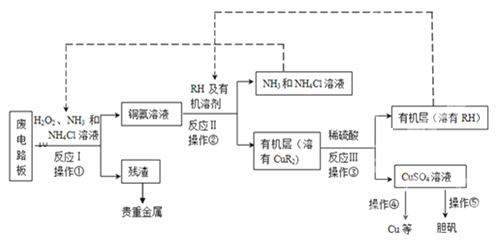
回答下列问题:
(1)反应I是将Cu转化为Cu(NH3)42+,反应中H2O2 的作用是_________________。请写出操作①的名称:________________。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,请写出该反应的离子方程式:_________________。操作②用到的主要仪器名称为___________,其目的是(填序号)__________。
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应III除了生成CuSO4之外,还生成另外一种产物是___________。
(4)操作④以石墨作电极电解CuSO4溶液,电解时的总反应式为________________。操作⑤由硫酸铜溶液制胆矾的主要步骤是___________________________________。
(5)流程中有三次实现试剂的循环使用,已用虚线标出两处,第三处的试剂是______。循环使用的NH4Cl在反应I中的主要作用是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl﹣、Mg2+、Ba2+、CO32﹣、SO42﹣ , 现取三份100mL溶液进行如下实验: ①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
A.K+不一定存在
B.100 mL溶液中含0.01 mol CO32﹣
C.Cl﹣可能存在
D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g) ![]() O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
C.氢气的燃烧热为241.8 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明氯的非金属性比硫强的反应是( )
A. CuCl2+H2S===CuS↓+ 2HCl
B. Cl2+ H2S===2HCl+ S
C. 3Cl2+6FeSO4===2Fe2(SO4)3+2FeCl3
D. H2SO4(浓)+ NaCl(固)===NaHSO4+ HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水是实验室常需临时配制的一种试剂,图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的、可用于向瓶中鼓入空气的仪器). 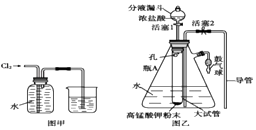
(1)氯水需临时配制的原因是:(用化学方程式表示).
(2)图甲所示装置中,烧杯内的液体是 .
(3)用图乙所示装置配制氯水时,操作步骤如下: ①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内.
②关闭活塞1,盖上分液漏斗上口玻璃塞.浓盐酸和大试管内的高锰酸钾粉末反应产生氯气.
③轻轻摇动瓶A,使氯气不断溶入水中.用图乙装置能在较短时间内得到饱和氯水.除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 .
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com