
 Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14)
Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14) 分析 晶胞中小黑色球数目为8×$\frac{1}{8}$=1,大黑色球2数目为12×$\frac{1}{4}$=3,故小黑色球为N3-、大黑色球为Cu+,补全晶胞结构可知,N3-离子周围有6个Cu+;
Cu+半径为a pm,N3-半径为b pm,则晶胞棱长为2(a+b)pm,进而计算晶胞体积、晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:晶胞中小黑色球数目为8×$\frac{1}{8}$=1,大黑色球2数目为12×$\frac{1}{4}$=3,故小黑色球为N3-、大黑色球为Cu+,补全晶胞结构可知,N3-离子周围有6个Cu+;
Cu+半径为a pm,N3-半径为b pm,则晶胞棱长为2(a+b)pm,晶胞体积为[2(a+b)×10-10 cm]3,晶胞质量为(64×3+14)÷NAg,则晶胞密度为[(64×3+14)÷NAg]÷[2(a+b) cm]3=$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3,
故答案为:6;$\frac{103}{4{N}_{A}(a+b)^{3}}$.
点评 本题考查了晶胞的计算,题目难度中等,明确常见晶胞结构为解答关键,注意掌握均摊法在晶胞计算中的应用,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用NH4Cl溶液蒸干制备NH4Cl固体 | |
| B. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 | |
| C. | 用重结晶法除去KNO3中混有的NaCl | |
| D. | 将混有少量氯化氢气体的Cl2通入NaOH溶液中除去氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
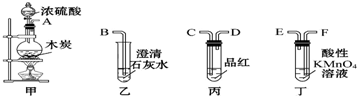
| A. | 按气流从左向右流向,连接装置的正确顺序是A→C→D→F→E→B | |
| B. | 丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| C. | 丙中品红溶液不褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| D. | 丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+HCl↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | Mg+Cl2$\frac{\underline{\;点燃\;}}{\;}$MgCl2 | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增大效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com