
| A. | 等浓度的 CH3COOH 与 KOH 任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的 pH=7 | |
| C. | 浓度均为 0.1 mol/L 的氨水和氯化铵溶液,水电离出的 c(H+)前者大于后者 | |
| D. | 常温下 pH 为 5 的盐酸溶液稀释 1000 倍后,pH 等于 8 |
分析 A.任何溶液都遵循电荷守恒,根据电荷守恒判断;
B.酚酞的不是范围为8-10,滴有酚酞的溶液呈无色,溶液可能为酸性;
C.弱碱抑制水的电离,盐类水解促进水的电离;
D.酸溶液无论稀释多少倍,都不可能呈碱性.
解答 解:A.任何溶液都遵循电荷守恒,则等物质的量浓度的CH3COOH溶液与KOH溶液任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-),故A正确;
B.在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,该溶液可能为酸性,此时溶液的pH不一定为7,故B错误;
C.氨水中存在:NH3•H20?NH4++OH-,抑制水的电离,氯化铵溶液存在:NH4++H20?NH3•H20+H+,促进水的电离,水电离出的 c(H+)前者小于后者,故C错误;
D.常温下pH为5的盐酸溶液稀释1000倍后,pH接近7,但小于7,溶液不可能呈碱性,故D错误;
故选A.
点评 本题考查溶液酸碱性与溶液pH的计算,题目难度中等,涉及离子浓度的比较、酸的稀释以及盐类水解等知识,题目难度中等,本题注意把握守恒方法的应用,B为易错点,注意酚酞的变色范围,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
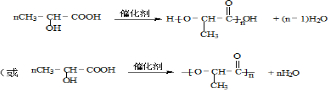
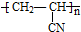 )混合物制作而成的复合材料.工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;聚丙烯腈单体分子中位于同一平面的原子数目最多为7个.
)混合物制作而成的复合材料.工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;聚丙烯腈单体分子中位于同一平面的原子数目最多为7个.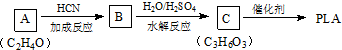
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
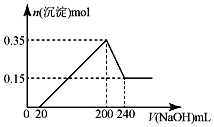 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
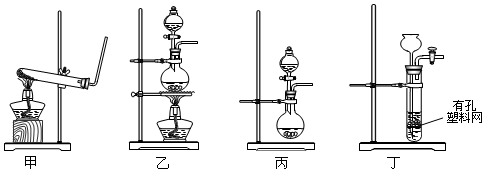
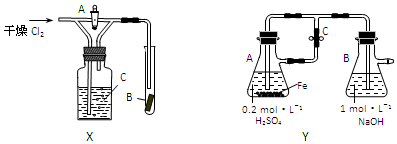
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1 mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}$×10-18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
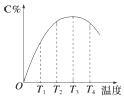 (1)估计下列各变化过程是熵增还是熵减.
(1)估计下列各变化过程是熵增还是熵减.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com